Lutembachers syndrom
 | |
| Lutembachers syndrom | |
|---|---|
| Detta tillstånd påverkar förmaket | |
| Specialitet |
Medicinsk genetik |
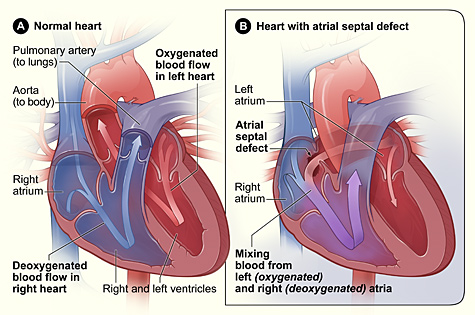
Lutembachers syndrom är en mycket sällsynt form av medfödd hjärtsjukdom som påverkar en av hjärtats kammare (vanligtvis förmaken ) såväl som en klaff (vanligen mitralisklaffen ) . Det är allmänt känt som både medfödd förmaksseptumdefekt (ASD) och förvärvad mitralisstenos (MS) . Medfödd (vid födseln) förmaksseptumdefekt hänvisar till ett hål i septumet eller väggen som skiljer de två förmaken; detta tillstånd ses vanligtvis hos foster och spädbarn. Mitralstenos hänvisar till mitralisklaffblad (eller klaffflikar) som fastnar vid varandra och gör öppningen för blod att passera från förmaket till ventriklarna mycket liten. Eftersom klaffen är så liten har blodet svårt att passera från vänster förmak till vänster kammare . Septumdefekter som kan uppstå med Lutembachers syndrom inkluderar: Ostium primum förmaksseptumdefekt eller ostium secundum som är vanligare.
Lutembachers syndrom drabbar kvinnor oftare än män. Det kan drabba barn eller vuxna; personen kan antingen födas med sjukdomen eller utveckla den senare i livet. Syndromet beskrevs första gången av René Lutembacher (1884–1968) från Paris 1916.
För att korrigera Lutembachers syndrom görs ofta operation. Det finns flera typer av operationer beroende på orsaken till Lutembachers syndrom (ASD Primum eller ASD Ostium Secundum med mitralstenos):
- Suturering (sömnad) eller placera en vävnadsfläck (liknande hudtransplantation) över hålet för att helt stänga öppningen
- Rekonstruktion av mitralis- och trikuspidalklaffen samtidigt som man lappar eventuella hål i hjärtat
- Enhetsstängning av ASD (t.ex. Amplatzer paraply eller CardioSEAL för att täta hålet) [ citat behövs ]
- Perkutan transkateterterapi
- Transkateterterapi av ballongklaffplastik för att korrigera MS
Symtom och tecken
Eftersom Lutembachers syndrom är känt för ASD och MS, kommer de flesta av de upplevda symtomen att vara associerade med ASD och MS. För de flesta förblir de asymtomatiska (inga symtom) men när symtom visas beror de främst på ASD och kommer att variera beroende på storleken på hålet i förmaken. Om patienten har en stor ASD kommer lungstockning (blod eller vätskeansamling i lungorna) att inträffa senare, men om patienten har en liten ASD kommer symtom att uppträda tidigt i sjukdomen. I allmänhet, såvida inte den ASD och mitralisstenosen som orsakar Lutembachers syndrom är allvarlig, kan symtom inte uppträda förrän under det andra och tredje decenniet av patientens liv. symptomen . Eftersom många av patienterna är asymtomatiska och symtom kanske inte dyker upp förrän senare i livet, varierar varaktigheten eller frekvensen av För symtom som hjärtklappning, ventrikulär överbelastning, hjärtsvikt och lungstockning kan dessa symtom vara plötsliga och inte så ofta eftersom de är mycket allvarliga symtom. För symtom som högt mitralis S1, pulmonell S2, mellandiastoliskt blåsljud, trötthet, minskad träningstolerans, viktökning, fotledsödem och smärta i övre högra kvadranten och ascities, kan dessa symtom vara mindre frekventa och allvarliga; deras varaktighet kan vara bara några sekunder, minuter eller till och med månader. [ citat behövs ]
Viktiga symtom
Viktiga symtom på Lutembachers syndrom till följd av ASD och MS kan variera från hjärtsvikt till lungstockning. [ citat behövs ]
- Höger ventrikulär överbelastning och högersidig hjärtsvikt: Båda orsakas av en stor ASD och MS (måttlig till svår).
- Hjärtklappning: Detta orsakas av att blod strömmar från vänster förmak till höger förmak vilket orsakar ett högre tryck i vänster förmak och leder till mitralisstenos. Båda förmaken kommer att vidgas (sträckas eller öppnas) vilket leder till framtida förmaksarytmier eller förmaksflimmer (Riaz).
- Pulmonell trängsel: När blod eller vätska samlas i lungorna; detta är vanligtvis ett symptom på mitralisstenos och en liten ASD.
- Högt mitralis S1 och bred fast delning av pulmonell S2: Det höga ljudet från mitralis S1 och den breda fixerade delningen av lung S2 är ett symptom på mitralisstenos. Ljuden orsakas ofta av en reducerad tryckgradient i mitralisområdet som orsakades av dekompression av vänster förmak från ASD och en förskjutning (förflyttning från normal position) av den nedre vänstra kammarens nedre del av hjärtat till den stora högra kammaren . Den andra hjärtljudsdelningen (S2) orsakas av det ökade högra hjärtats blodflöde genom ASD, vilket orsakar en sen stängning av lungkomponenten i S2 såväl som minskat vänsterkammar- och aortablodflöde.
- III/IV mellandiastoliskt blåsljud, tidigt systoliskt blåsljud: Detta blåsljud orsakas av ett ökat blodflöde genom trikuspidalklaffen på grund av ASD; det hörs bäst i det vänstra nedre bröstpartiet eller i botten av hjärtat (apex).
Mindre symtom
- Trötthet: symtom orsakas av minskat systemiskt (syresatt blod till resten av kroppen) flöde. När patienten har MS och blodet strömmar från det vänstra förmaket till det högra förmaket, minskar det framåtgående blodflödet in i den vänstra kammaren, vilket leder till en minskning av det systemiska blodflödet; detta orsakar trötthet.
- Minskad träningstolerans: symtom som också orsakas av minskat systemiskt (syresatt blod till resten av kroppen) flöde. Precis som med trötthet, när patienten har MS och blodet strömmar från vänster förmak till höger förmak, minskas det framåtgående blodflödet in i vänster kammare, vilket leder till en minskning av det systemiska blodflödet; detta orsakar trötthet och därmed minskad träningstolerans.
- Viktökning: detta är vanligt förekommande hos patienter med stor ASD och kan vara ett symptom på att utveckla högersidig hjärtsvikt. Eftersom det finns ett kroniskt ökat blodflöde från vänster till höger genom atrierna kommer detta i framtiden att leda till högersidig hjärtsvikt.
- Ankelödem: Detta orsakas också av en stor ASD och har samma symtom och orsaker som ses vid viktökning och smärta i den övre högra kvadranten. Eftersom blodflödet inte sker korrekt och hjärtat pumpar under ansträngning, kommer blod och vätska att samlas i anklarna.
- Smärta i övre högra kvadranten: Orsakas också av stor ASD; har samma symtom och bakomliggande orsaker som viktökning och fotledsödem.
- Ascites: Ascite är känt som onormal ansamling av vätska i utrymmen mellan bukslemhinnan och bukorganen. Samma symtom och orsaker som vikt, ökning, fotledsödem och smärta i övre högra kvadranten.
Mindre vanliga symtom
- Paroxysmal nattlig dyspné, ortopné och hemoptys (tecken på pulmonell venös trängsel): dessa symtom är mindre frekventa vid Lutembachers syndrom och är mer associerade med MS och liten ASD eller patienter som utvecklar omvänt Lutembachers syndrom. Detta symptom orsakas av mitralisstenos.
Relaterade störningar
Orsaker
Lutembacher orsakas indirekt av hjärtskador eller störningar. Lutembachers syndrom orsakas antingen av fosterskador där hjärtat inte lyckas stänga alla hål i väggarna mellan förmaken eller av en episod av reumatisk feber där skada görs på hjärtklaffarna såsom mitralisklaffen och resulterar i en öppning av hjärtväggen mellan atrierna. Med Lutembachers syndrom ses vanligtvis ett foster eller spädbarn ha ett hål i hjärtväggen (interatrial) som skiljer höger och vänster förmak åt. Normalt under fosterutvecklingen går blodet förbi lungorna och syresätts från moderkakan. Blod passerar från navelsträngen och rinner in i det vänstra förmaket genom en öppning som kallas foramen ovale; foramen ovale är ett hål mellan de två atrierna. När ett barn föds och lungorna börjar fyllas med luft och blodflödet i hjärtat förändras, stänger en vävnadsflik (något som en falldörr) som kallas septum primum foramen ovale eller hålet mellan de två förmaken och blir en del av förmaksväggen. Om hålet mellan de två förmaken inte stängs efter födseln leder till en störning som kallas ASD primum. De vanligaste problemen med en öppning i hjärtat med Lutembachers syndrom är Ostium Secundum. Ostium Secundum är ett hål som finns i vävnadsfliken (septum primum) som så småningom kommer att stänga hålet mellan de två förmaken efter födseln. Med båda typerna av ASD kommer ASD vanligtvis att få blodflödet från höger förmak att hoppa över att gå till höger kammare och istället strömma till vänster förmak. Om mitralisstenos (härdningen av vävnadsfliken känd som en ventil som öppnar och stänger mellan vänster förmak och kammare för att kontrollera blodflödet) också är närvarande, kommer blod att flöda in i det högra förmaket genom hålet mellan förmaksväggen istället för att flöda in i vänster ventrikel och systemisk cirkulation. Så småningom leder detta till andra problem som att höger ventrikel sviker och ett minskat blodflöde till vänster ventrikel.
Utöver ASD kan MS antingen förvärvas (förekommer antingen från en episod av reumatisk feber eller mamman har eller haft reumatisk feber under graviditeten) eller medfödd (barnet som föds med sjukdomen). Med kombinationen av både ASD och MS kan hjärtat vara under svår påfrestning när det försöker flytta blod genom hjärtat och lungorna. [ citat behövs ]
Mekanism
Det finns ingen exakt mekanism för Lutembachers syndrom utan istället en kombination av störningar som ett resultat av förmaksseptumdefekt (ASD) och/eller mitralisklaffstenos. Man tror att ASD orsakas av misslyckandet med att stänga hålet (foramen ovale) mellan höger och vänster förmak som normalt finns i hjärtat under fosterutvecklingen; skapandet av ett hål mellan atriumet kan också förvärvas. Det finns två typer av ASD: Ostium secundum och ASD Primum. [ citat behövs ]
Förmaksseptumdefekt Primum
Att hålet mellan höger och vänster förmak inte stängs kort efter födseln är orsaken till ASD primum. Under fosterutvecklingen kommer blod att passera från navelsträngen och strömma in i det vänstra förmaket genom ett hål mellan de två förmaken. När ett barn väl är fött och lungorna börjar fyllas med luft förändras hjärtats blodflöde; en vävnadsflik (septum primum) stänger normalt hålet (foramen ovale) mellan de två förmaken och blir en del av förmaksväggen. Under ASD primum, efter födseln, är hålet inte helt stängt vilket tillåter blod att strömma in i höger förmak från vänster förmak. Sedan passerar blodet till höger kammare detta kommer att öka lungartärtrycket På grund av det felaktiga blodflödet, symtom som trötthet (från minskat systemiskt blodflöde), hjärtklappning (från blod som rinner från vänster förmak till höger förmak), viktökning, ödem, höger smärta i övre bröstet (alla orsakade från vänster till höger förmaks blodflöde), och paroxysmal nattlig dyspné (andnöd under sömn), ortopné (svårigheter att andas när du ligger ner) och hemoptys eller upphostning av blod (alla orsakade av liten ASD som orsakar blodflöde från vänster till höger förmak).
Förmaksseptumdefekt Ostium secundum
Under den vanligare formen av Lutembachers syndrom, ASD Ostium secundum, bildas ett hål i vävnadsfliken (septum primum) som bör sluta mellan de två förmaken efter födseln. Med uppkomsten av ett hål skapat i vävnadsfliken som stänger det större hålet mellan vänster och höger förmak, kan blod åter strömma från vänster förmak till höger. Ostium secundum orsakar många av samma symtom som ses i ASD primum. Med endera typen av ASD kommer blod att flöda från höger förmak och hoppa över höger kammare (eller mycket lite strömma in i kammaren) och istället flöda till vänster förmak vilket introducerar möjligheten för blod som saknar syre för att gå resten av kroppen. Ibland bestäms blodflödets riktning till stor del av vänster och höger kammares förmåga att klämma (sammandraga sig) och slappna av (efterlevnad).
Förutom medfödda defekter eller fosterskador som orsakar ASD, tros ASD också vara förvärvad. Under perkutana interventionsprocedurer såsom mitralisklaffplastik (en kirurgisk process som görs för att reparera en mitralisklaff), kommer 11-12 % av individerna att utveckla ASD som tillåter blod att flöda från vänster förmak till höger.
Mitralklaffstenos
Den andra orsaken till Lutembachers syndrom är mitralisstenos (MS). MS kan orsakas av fosterskador, reumatisk feber eller bara stress för hjärtat på grund av ASD; eftersom MS kan orsakas av flera saker finns det ingen exakt mekanism utan många mekanismer eller orsaker. Om mitralisklaffstenos är ett resultat av fosterskador under utvecklingen som härrör från reumatisk feber, kan flera saker inträffa i hjärtat. Reumatisk feber gör att immunsystemet attackerar sina egna proteinvävnader, vilket leder till att det bildas skador på mitralisklaffarna. När flikarna läker över tiden, tappar flikarna sin filmiga och floppighet vilket resulterar i solida, styva flikar. Förlusten av ordentliga flappiga mitralisklaffar gör det svårare för klaffarna att öppna och låta blodet strömma igenom. Som ett resultat av att blodflödet stoppas eller bromsas av den felaktiga ventilen, börjar trycket byggas upp i hjärtat. Man trodde en gång i tiden att en ASD inte redan är närvarande, kan bildas på grund av MS, men man tror nu att ASD är antingen en fosterskada eller förvärvad från kirurgiska ingrepp.
Sammantaget har Lutembachers syndrom ingen säker mekanism utan en kombination som ett resultat av ASD och MS.
Diagnos
Lutembachers syndrom diagnostiseras främst genom fysiska undersökningar av hjärtljud, elektrokardiogram, bröströntgen, transthorax eller transesofageal ekokardiografi, färgflödeskartläggning och doppleravbildning. Användning av de olika testerna kan hjälpa till att skilja andra möjliga tillstånd som mitralisuppstötningar , Ebsteins sjukdom , kammarseptumdefekt (VSD) .
Fysiska undersökningar
En fysisk undersökning kommer att göras för att kontrollera onormala hjärtljud, hjärttillstånd, blodtryck, lungor, hjärtklappning, ödem, viktökning, ascites eller andra onormala symtom. Blod kan också tas för att hjälpa till att fastställa orsaken till trötthet, bestämning av ascites, andra hälsoproblem som kan vara nära relaterade till att orsaka symtom som njure, lever, immunförsvar (tecken på reumatisk feber), onormala glukosnivåer. [ citat behövs ]
Elektrokardiogram
Elektrokardiogram (EKG) används för att bestämma platsen, storleken, riktningen för blodflödet genom förmakshålet, hemodynamiken i höger kammare (blodcirkulationen), trikuspidalklaffen och funktionen hos vänster kammare. EKG kan också användas för att bestämma hjärtats rytm för att avgöra om det finns en indikation på sinusrytm eller förmaksflimmer. I EKG kommer p-vågsmorfologin att studeras för eventuella avvikelser. Om P-vågen (förmaksdepolarisering) under EKG är lång, bred eller delad vågor i avledning II och åtföljs av en djup negativ kraft i V1, skulle detta anses vara onormalt; endast en våg ska vara associerad med P-vågen. Dessutom, i ett EKG kommer QRS morfologi och axel att undersökas för eventuella abnormiteter. Om EKG visar en avvikelse på höger axel som är onormal eller ett höger grenblock (detta skulle innebära att det inte gick någon signal genom förmaket för att instruera ventrikeln att dra ihop sig eller pressa ut blod ur ventrikeln).
Bröstradiogram
Ett bröströntgengram kan ges till en patient för att fastställa: [ citat behövs ]
- Pulmonell överflöd: testet hjälper till att avgöra om det finns en vänster-till-höger-shunt, vilket betyder att blodet strömmar från vänster förmak till höger genom ett hål mellan de två förmaken.
- Mild förstoring av vänster förmak: testet hjälper till att avgöra om det vänstra förmaket är förstorat på grund av omväxlande blodflöden
- Förstoring av höger kammare: testet hjälper till att avgöra om kammaren är förstorad på grund av en ökning av blod över det normala eller om kammaren måste arbeta hårdare än normalt för att pumpa ut blod ur kammaren.
- Lungartärförstoring: testet hjälper till att avgöra om det finns en stor volym blod i lungvenerna och artärerna än normalt
- Mitralklaffens förkalkning sent i livet: testet kommer att hjälpa till att avgöra om mitralklaffen eller klaffarna blir härdade och tappar sin floppighet.
- pulmonell kärlstockning, markerad förstoring av vänster förmak: testet hjälper till att avgöra om det finns tecken på MS och liten ASD och hur allvarliga båda är.
Transthorax eller transesofageal ekokardiografi
Transthorax eller transesofageal ekokardiografi tvådimensionella bilder som kan göras av hjärtat. De kan användas för att bestämma stadierna av Lutembachers syndrom. De används för att bestämma:
- Stort vänster förmak: testet kan hjälpa till att avgöra om det vänstra förmaket är förstorat till ett stort blodflöde än ovanligt
- Stort högra förmak och kammare: testet hjälper till att avgöra om höger förmak och kammare är förstorade på grund av ett större blodflöde
- ASD: testet hjälper till att avgöra om det finns ett hål mellan de två förmaken och om blod strömmar genom båda
- Stenotisk mitralisklaff: testet hjälper till att avgöra om blodflödet genom mitralisklaffen är normalt eller om mitralisklaffen är stel, har en minskad öppning och begränsar blodflödet genom den.
Färgflödeskartläggning och doppleravbildning
Ett färgflöde och doppleravbildning används för att bekräfta förekomsten samt utvärdera svårighetsgraden av ASD och MS.
Bröstkorgsröntgen
En lungröntgen kommer att göras för att bestämma storleken på hjärtat och blodkärlen som levererar blod till lungorna.
Hjärtkateterisering
Hjärtkateterisering görs för att bekräfta en diagnos; det görs inte rutinmässigt tidigare. Den kan också användas för att utvärdera svårighetsgraden av ASD och mäta mitralisklaffområdet. För att fastställa närvaron av ASD förs en kateter genom det misstänkta hålet mellan förmaket in i det vänstra förmaket. [ citat behövs ]
Behandlingar
För att behandla Lutembachers syndrom måste de bakomliggande orsakerna till störningen först behandlas: mitralisstenos och förmaksseptumdefekt. Lutembachers syndrom behandlas vanligtvis kirurgiskt med behandlingar som: [ citat behövs ]
- perkutan transkateterterapi för MS
- Enhetsstängning av ASD
Perkutan transkateterbehandling för MS kan innefatta transkateterterapier såsom ballongklaffplastik .
Perkutan transkateterterapi
Perkutan transkateterterapi används för att reparera mitralisklaffen och ibland septum. Vid perkutan ballongmitralisklaffplastik, med hjälp av en kateter, placeras en ballong såsom Inoue-ballongen i blodkärlen i ljumskområdet och ballongen styrs till hjärtat. Om ett hål inte redan finns, kan ett litet hål behöva föras in i förmaken och föras in i mitralisklaffen genom vänster förmak; ballongen blåses sedan upp. Ballongen inuti mitralisklaffen kommer att blåsas upp och tömmas flera gånger för att vidga ventilöppningen tills öppningen är tillfredsställande; ballongen kommer sedan att tömmas och tas bort.
Fördelen med att använda perkutana ingrepp istället för öppen hjärtoperation är att man inte behöver narkos, blodtransfusioner och att återhämtningstiden går snabbare. Nackdelen med denna procedur är bristen på upprepade och transseptala procedurer om de behövs senare. Också om patienten senare utvecklar ett återfall av MS, kommer operation att behöva utföras där man använder mer undvikande tekniker. Dessutom, om ett hål behövs för att föras in i förmaken för att få tillgång till mitralisklaffen, finns det en risk för att utveckla ASD sekundärt.
Bieffekter
Möjliga biverkningar från denna icke-invasiva procedur kan vara: [ citat behövs ]
- feber
- Bröstsmärta
- Andnöd
- Ovanlig svullnad eller viktökning
- Svullnad, blödning, förändring i hudfärg vid platsen för initial kateterisering i ljumsken eller smärta i ljumsken.
Om något av ovanstående symtom uppträder är det viktigt att kontakta din läkare för att förhindra ytterligare ett förfall av mitralisstenos. För att säkerställa god hälsa rekommenderas rutinmässiga läkarbesök, diet, viktminskning, läkares godkänd träning och användning av antibiotika vid tandvård och andra procedurer.
Stängning av enheten
För att behandla ASD kan en enhetsstängning användas. Faktum är att en ASD-stängning ofta rekommenderas för vissa fall, såsom med en patient som har en betydande shunt från vänster till höger med en pulmonell och/eller systemisk flödesfraktion av Qp/Qs >1,5. Det är bäst att utföra denna procedur/operation mellan 2–4 års ålder. [ citat behövs ] Förslutningen görs med två metoder: interventionellt eller kirurgiskt. [ citat behövs ]
Interventionellt
Denna procedur görs genom att placera en enhet som Amplatzer "paraply", CardioSEAL som liknar perkutan transkateterterapi. En kateter förs in i kärlen och träs till hjärtat och förs in i ASD som stänger defekten. [ citat behövs ] Annan stängningsanordning som har använts är GORE HELEX septal occluder. Efter att enheten har satts in och täcker defekten kommer vävnad med tiden att växa över implantatenheten så att den blir en del av hjärtat. Antikoagulerande medicin kommer att ges till patienten under de första sex månaderna efter operationen: aspirin, klopidogrel eller warfarin (Coumadin).
Kirurgiskt
Denna procedur görs genom öppen hjärtkirurgi (sternotomi eller torakotomi) med hjälp av en ECC där hjärtat stoppas för att tillåta ett system av speciella kanyler att placeras. Hålet stängs med en direkt sutur (sömnad) om hålet är tillräckligt litet eller om hålet är större, sy (sy) en liten lapp av hjärtsäcken (hjärtvävnad eller hud) eller tyg för att stänga hålet. [ citat behövs ]
För att öka livskvaliteten efter ASD-ingrepp/operationer bör patienter genomgå en fysisk undersökning och EKG var 3:e, 6:e och 12:e månad hos sin kardiolog. För många patienter med secundum ASD closure reparation kan de återgå till sina normala aktiviteter om inte deras ingrepp var hjärtkateterisering som i det här fallet borde vila i några dagar. Alla patienter bör stanna på blodförtunnande medicin i minst 6 månader och upp till ett år om inte patienten hade en stroke där de alltid skulle få blodförtunnande medel. Patienter med kranskärlssjukdom eller pulmonell hypertoni kommer att ta ytterligare läkemedel som beskrivs av sin läkare. För patienter som genomgått en hjärtoperation för att reparera defekten eller fått en transkateterförslutningsanordning, kommer de att behöva ta någon form av antibiotika för att förhindra infektioner som endokardit i minst 6 månader efter ingreppet.
Framgången med ASD-stängning är mycket hög, 96 % för perkutana ingrepp och 100 % av ASD-operationer som hittats av en forskargrupp. Ingen patient visade sig ha dött av vare sig interventionell eller kirurgisk behandling och endast 7,2 % av patienterna som fick en enhet och 24,0 % av patienterna som opererades hade komplikationer. Sjukhusvistelsen för varje grupp varierade också, operationsgruppen var 3,4 ± 1,2 dagar och apparatgruppen 1,0 ± 0,3 dagar. Som framgår av denna studie var prognosen god och livskvaliteten kunde vara utmärkt. [ citat behövs ]
Bieffekter
Biverkningar med stängning av interventionsanordningar har ännu inte fått omfattande stöd.
Möjliga biverkningar från proceduren för stängning av ASD-enheter kan vara: [ citat behövs ]
- feber
- Bröstsmärta
- Svullnad
- Svullnad, blödning, förändring i hudfärg vid platsen för initial kateterisering i ljumsken, eller smärta i ljumsken
Med kirurgisk stängning är den normala risken för infektion, feber och blodproppar bland riskerna. Om några tecken på infektion som svullnad, smärta eller feber finns, bör patienten söka läkarvård. Patienter som har ASD reparerad senare i livet löper också en högre risk att utveckla förmaksflimmer, särskilt om enheten inte är stabil.
Senare forskning
Genom att undersöka fördelarna med att använda perkutan behandling som ett alternativ till kirurgiska metoder för att korrigera MS och ASD, fann man att kombinerad perkutan behandling (inklusive ballongklaffplastik för MS och Amplatzer septal occluder för stängning av ASD) har förbättrat patientens planimetriska mitralisklaff area till 2,1 cm (jämfört med tidigare 1,5 cm), maximal diastolisk gradient till 9 mmHg (jämfört med tidigare 17 mmHg) och genomsnittlig diastolisk gradient till 4 mmHg (jämfört med tidigare 9 mmHg).
I en annan studie utvecklade kirurger ett sätt att använda percanteous terapi i svåra situationer. I denna studie utvecklade de en teknik för att använda Inoue-ballongen vid valvuloplastik men för att föra in en tråd i det vänstra förmaket innan ballongen sätts in. Detta gjorde det möjligt för kirurgerna att vara mer exakta i behandlingen av mitralisklaffen och inte få ballongen att glida ur sin plats; tråden fungerade som en guide för att föra in ballongen.
Andra perkutana ingrepp vid sidan av ballongklaffplastik för MS har undersökts. Perkutan broschyrplikation (Edge-to-Edge Leaflet Repair) undersöks som ett sätt att öka öppningen av mitralisklaffen genom att klämma fast mitralisbladen. Klämmorna levereras till mitralisklaffen genom en kateter som med ballongen och kläms sedan fast på mitralisklaffen. Av patienterna som fick denna behandling, uppnådde 74 % av patienterna kirurgisk framgång, och efter 1 år räddades 68 % från att dö, 90 % från att behöva opereras eller dö av bristen därav, en prognos på 76,3 % efter tre år.
Med tanke på de många möjliga behandlingar som kommer, fortsätter framtida forskning att hitta bättre metoder för att behandla Lutembacher-patienter icke-invasivt som med perkutan terapi. Utan att framgångsrikt behandla Lutembachers kan allvarligare komplikationer uppstå såsom hjärtsvikt eller till och med störningar som Eisenmengers syndrom.
Ytterligare referenser
- Goldman, Lee (2011). Goldmans Cecil Medicine (24:e upplagan). Philadelphia: Elsevier Saunders. ISBN 978-1437727883 .