Järnsvarselement
| Järnsvarselement | |
|---|---|
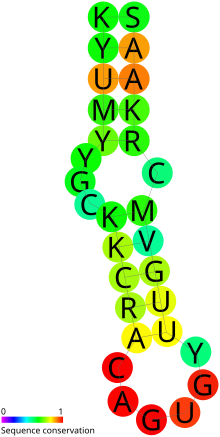 Förutspådd sekundär struktur och sekvensbevarande av IRE-
| |
| identifierare | |
| Symbol | VREDE |
| Rfam | RF00037 |
| Övriga uppgifter | |
| RNA -typ | Cis-reg |
| Domän(er) | Eukaryota |
| SÅ | SO:0000233 |
| PDB- strukturer | PDBe |
Inom molekylärbiologi är järnsvarselementet eller järnsvarselementet ( IRE ) en kort bevarad stamslinga som är bunden av järnsvarsproteiner ( IRPs, även kallade IRE-BP eller IRBP). IRE finns i UTR (oöversatta regioner) av olika mRNA vars produkter är involverade i järnmetabolism . Till exempel innehåller mRNA för ferritin (ett järnlagringsprotein) en IRE i dess 5' UTR . När järnkoncentrationen är låg binder IRP:er IRE i ferritin-mRNA:t och orsakar minskade translationshastigheter. Däremot leder bindning till flera IRE i transferrinreceptorns 3 ' UTR (involverad i järnupptagning) till ökad mRNA-stabilitet.
Handlingsmekanism
De två ledande teorierna beskriver hur järn förmodligen interagerar för att påverka posttranslationell kontroll av transkription. Den klassiska teorin antyder att IRP, i frånvaro av järn, binder flitigt till mRNA IRE. När järn är närvarande interagerar det med proteinet för att få det att frigöra mRNA. Till exempel, vid höga järnförhållanden hos människor, binder IRP1 till ett järn-svavelkomplex [4Fe-4S] och antar en akonitaskonformation som är olämplig för IRE-bindning. Däremot bryts IRP2 ned under höga järnförhållanden. Det finns variation i affinitet mellan olika IRE och olika IRP:er.
I den andra teorin tävlar två proteiner om IRE-bindningsstället – både IRP och eukaryot initieringsfaktor 4F (eIF4F). I frånvaro av järn binder IRP cirka 10 gånger mer ivrig än initieringsfaktorn. Men när järn interagerar vid IRE, får det mRNA att ändra sin form, vilket gynnar bindningen av eIF4F. Flera studier har identifierat icke-kanoniska IRE. Det har också visat sig att IRP binder till vissa IRE bättre än andra.
Strukturella detaljer . Den övre helixen av de kända IREs visar starkare bevarande av struktur jämfört med den nedre helixen. Baserna som utgör spiralerna är variabla. Mellanstammen utbuktande C är en mycket karakteristisk egenskap (även om detta har setts vara ett G i ferritin IRE för hummer). Den apikala slingan av de kända IREs består alla av antingen AGA- eller AGU-tripletten. Detta kläms av en parad GC och det finns dessutom en utbuktad U, C eller A i den övre helixen. Kristallstrukturen och NMR-data visar ett utbuktande U i den nedre stammen av ferritin IRE. Detta överensstämmer med den förutsagda sekundära strukturen. IRE i många andra mRNA har inget stöd för denna utbuktade U. Följaktligen har två RFAM-modeller skapats för IRE-en med en utbuktad U och en utan.
Gener med IRE
Gener som är kända för att innehålla IRE inkluderar FTH1 , FTL , TFRC , ALAS2 , Sdhb, ACO2 , Hao1, SLC11A2 (kodar DMT1), NDUFS1, SLC40A1 (kodar ferroportinet) CDC42BPA , CDC14A , EPAS1 .
Hos människor har 12 gener visat sig transkriberas med den kanoniska IRE-strukturen, men flera mRNA-strukturer, som är icke-kanoniska, har visat sig interagera med IRP och påverkas av järnkoncentration. Programvara och algoritmer har utvecklats för att lokalisera fler gener som också är känsliga för järnkoncentration.
Taxonomiskt intervall . IRE finns över ett varierat taxonomiskt område - främst eukaryoter men inte i växter.
Processer som regleras av IRE
Många gener som regleras av IRE har tydliga och direkta roller i järnmetabolismen . Andra visar ett mindre uppenbart samband. ACO2 kodar för ett isomeras som katalyserar den reversibla isomeriseringen av citrat och isocitrat . EPAS1 kodar för en transkriptionsfaktor involverad i komplexa syreavkänningsvägar genom induktion av syrereglerade gener under låga syreförhållanden. CDC42BPA kodar för ett kinas med en roll i cytoskelettomorganisation . CDC14A kodar för ett fosfatas med dubbel specificitet som är inblandat i cellcykelkontroll och interagerar också med interfascentrosomer.
Se även
externa länkar
- Sida för Iron response element - Model I på Rfam
- Sida för Iron response element - Model II på Rfam
- Transterm-sida för Iron Responsive Element
- Genomiska intervallfiler med IRE-förutsägelser gjorda med hjälp av RFAM-modellerna på det mänskliga genomet av hg18
- Iron Responsive Elements Prediction Server arkiverad 2012-04-25 på Wayback Machine