Genotyp-första tillvägagångssätt
Genotyp - först-metoden är en typ av strategi som används i genetiska epidemiologiska studier för att associera specifika genotyper till uppenbara kliniska fenotyper av en komplex sjukdom eller egenskap. I motsats till "fenotyp-först", den traditionella strategin som har varit vägledande för genomomfattande associationsstudier (GWAS) hittills, karaktäriserar detta tillvägagångssätt individer först av en statistiskt vanlig genotyp baserad på molekylära tester före klinisk fenotypisk klassificering. Denna metod för gruppering leder till patientutvärderingar baserade på en delad genetisk etiologi för de observerade fenotyperna, oavsett deras misstänkta diagnos. Således kan detta tillvägagångssätt förhindra initial fenotypisk bias och möjliggöra identifiering av gener som utgör ett betydande bidrag till sjukdomens etiologi .
Detta tillvägagångssätt är opåverkat av fenotypisk heterogenitet, ofullständig penetrans och nivåer av uttrycksfullhet. Därför är den användbar vid komplexa sjukdomar som också överlappar varandra, såsom autismspektrumstörning och intellektuell funktionsnedsättning , vilket gör det möjligt att särskilja sjukdomarna och specifika undertyper av sjukdomen baserat på det genomiska innehållet som kan bestämmas.
För närvarande används genotyp-först-metoden främst för forskningsmål. Emellertid kan implikationerna från dessa studier ha värdefulla kliniska tillämpningar, inklusive förbättrad diagnos, rådgivning och stödgrupper för individer med samma genetiska etiologi.
Bakgrund
Initialt användes idén om att identifiera genotypen av individer och därefter deras associerade fenotyp(er) först i tidiga cytogenetiska studier. Runt 1960 ledde upptäckten av Trisomi 21 till insikten att genetik kunde användas för att förutsäga fenotyper. Från 1960- till 1990-talet användes cytogenetiska tekniker såsom kromosombandning och fluorescens in situ hybridisering (FISH) för att identifiera och fenotypiskt karakterisera patienter med kromosomavvikelser.
Komplexa sjukdomar och egenskaper utgör många svårigheter för epidemiologiska studier på grund av deras karaktär som multifaktoriella sjukdomar. Mer än en gen kan ligga bakom en komplex sjukdom och bidrar generellt till en mindre effekt än vad som observeras vid monogena sjukdomar ( Mendelska sjukdomar) . Dessutom uppvisar många av dessa komplexa sjukdomar olika fenotyper såväl som ett brett spektrum av uttrycksförmåga och penetrans. Gener kan också vara pleiotropa , vilket står för många till synes distinkta kliniska fenotyper. Dessa egenskaper begränsar förmågan hos både forskning och kliniska studier att utse kausala gener eller varianter av de observerade fenotyperna och att klassificera störningar.
Kliniker börjar inse behovet av att klassificera genomiska sjukdomar efter en gemensam genotyp snarare än en vanlig fenotyp och hur genotyp-först-metoden kan gynna detta syfte.
Metoder
Flera metoder kan användas med en genotyp-först-metoden, men följande steg ingår vanligtvis:
- Upprättande av en studiepopulation och genotypning
- Analys av genomiska varianter av intresse som finns i studiepopulationen
- Studiepopulationer sätts ihop baserat på genotyp
- Association av genotyp till fenotyp(er) inom respektive grupp
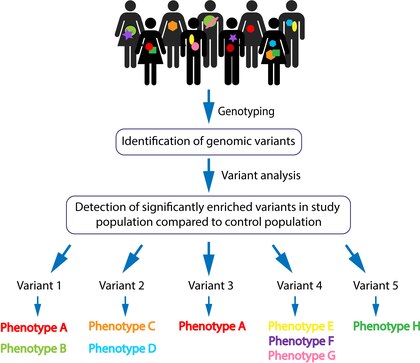
Genotypningen genereras med hjälp av nästa generations sekvenseringsteknologier (inklusive helgenomsekvensering och exomsekvensering ) och mikroarrayanalyser . Rådata analyseras sedan statistiskt för populationsbaserad frekvens av varianterna. Vanliga varianter filtreras bort och patogenicitet bestäms genom förutspådda genetiska implikationer. Dessa steg möjliggör identifiering av förmodade mycket penetrerande varianter och deras specifika plats . De valda varianterna sekvenseras vanligtvis för validering (genom riktad Sanger-sekvensering) . Validerade genomiska varianter kan sedan analyseras för återfall bland drabbade individer inom kohorten. Patogeniciteten hos en genomisk variant är statistiskt baserad på dess signifikant rikliga närvaro hos de drabbade jämfört med de opåverkade individerna, inte uteslutande på variantens skadlighet. En kandidatvariant kan sedan associeras med en delad fenotyp med strävan att allt eftersom fler patienter som blottar samma variant med samma fenotyp kommer att identifieras, kan en starkare association göras. Slutligen görs en avgränsning mellan en specifik variant till associerade kliniska fenotyper [Figur 1].
Kliniska implikationer och exempel
Genotyp-först-metoden har använts för att diagnostisera patienter med sällsynta sjukdomar, identifiera nya sjukdomar genotyp-fenotyper associationer och karakterisera ovanliga eller heterogena sjukdomar baserat på patientens genotyp. År 2014 användes genotyp-första-metoden för att bedöma sällsynta och lågfrekventa varianter i den finska befolkningen. Eftersom den finska befolkningen är isolerad och nyligen har genomgått en befolkningsflaskhals, i förhållande till andra länder, erbjuder det två huvudsakliga fördelar för genotyp-första studier. Skadliga varianter finns vid högre frekvenser inom ett mindre spektrum av sällsynta varianter i flaskhalsade grundarpopulationer. Genom att jämföra de varianter som hittats med hjälp av helexomsekvensering (WES) i den finska befolkningen med WES från en kontrollgrupp av icke-finska européer, sågs varianter av funktionsförlust (LOF) med en högre frekvens i den finska befolkningen. Fenotyperna hos finska individer med dessa LOF-varianter analyserades sedan för att fastställa nya genotyp-fenotypassociationer. Dessa associationer som upptäcktes inkluderade en som kunde vara dödlig för embryon, information som kanske inte har upptäckts i forskning med hjälp av en fenotyp-först-metod. Dessutom upptäckte forskare också nya splitsningsvarianter i LPA-genen som minskar nivåerna av apolipoprotein A och erbjuder en skyddande fenotyp mot hjärt-kärlsjukdom.
Genotyp-första bedömning håller på att bli standardmetoden för klinisk diagnos av komplexa heterogena sjukdomar. Mikroduplicerings- och mikrodeletionssyndrom har en rad egenskaper, inklusive intellektuell funktionsnedsättning och utvecklingsförsening , som varierar i svårighetsgrad vilket gör patienter med dessa syndrom mycket svåra att diagnostisera. Sedan utvecklingen av nästa generations sekvenseringsteknologier har kliniker kunnat använda en genotyp-första metod för att gruppera dessa patienter baserat på deras mikrodeletion eller duplicering och dokumentera sjukdomsdragen i dessa grupper. Kromosomal mikroarrayanalys, i synnerhet, används kliniskt för att hjälpa till att diagnostisera patienter med mikrodeletions- och mikroduplikationssyndrom. I sjukdomar, såsom Autism Spectrum Disorder (ASD), där det är utmanande att differentiera patienter i sjukdomssubtypsgrupper baserat på fenotyp, tillåter genotypförsta studier klassificering av patienter i subtyper baserat på deras genetik. Detta kommer i sin tur att ge en större förståelse för de genetiska orsakerna till ASD, och skulle i framtiden kunna definiera specifika subtyper av ASD för patienter som ska diagnostiseras.
Genotyp-först forskning, genom identifiering av nya sjukdomsassocierade gener, kan också gynna läkemedelsföretag och läkemedelsutveckling. För komplexa sjukdomar, med användning av fenotyp första gen-association, är utvecklingen av terapeutika ofta misslyckad på grund av att flera gener bidrar till en sjukdom. Med genotyp-först associationer identifieras det potentiella terapeutiska målet först.
Fördelar och begränsningar
Fördelar
- En förändring mot att karakterisera individer med en gemensam genotyp snarare än den kliniska presentationen kommer att göra det möjligt att klassificera nya syndrom och den genetiska klassificeringen av vissa sjukdomssubtyper, eftersom sekvenseringen blir billigare, snabbare och mer effektiv.
- Nedärvning av en genomisk variant från en frisk förälder skulle inte resultera i att den utesluts från variantanalys, och därigenom förklara modifierarnas roll för fenotypiskt resultat.
- Detta tillvägagångssätt är opåverkat av fenotypisk heterogenitet, ofullständig penetrans och uttrycksfullhet.
- Detta tillvägagångssätt bidrar till att studera både uttrycksförmåga, pleiotropi och sporadiska mutationer.
- Detta tillvägagångssätt undersöker mycket penetrerande mutationer som är associerade med sjukdomen oavsett genetisk bakgrund.
- Omfattande och detaljerad fenotypning är möjlig även med ett litet antal patienter med gemensam genetisk etiologi.
- Detta tillvägagångssätt kan identifiera atypiska presentationer av sjukdom när den används diagnostiskt.
Begränsningar
- Fenotypen kan förändras med tiden (t.ex. blir allvarligare, förändring i fysisk plats) vilket gör studier av genotyp först till ett antagande om variantens roll i sjukdomsmanifestationen vid en specifik tidpunkt. Därför är longitudinell uppföljning viktig för att genotyp-fenotypassociationen ska kunna värderas med tiden och undersöka sjukdomens prognos.
- Identifierade varianter som kan bidra till en mild fenotyp, eller till ett antal fenotyper, skulle inte vara fördelaktiga för att fastställa diagnos och prognos. Men i framtiden, eftersom fler sjukdomssubtyper klassificeras, kan milda fenotyper ha mer relevans.
- Genotyp-fenotyp association bygger på presentationen av kliniskt igenkännbara fenotyper.
- Som ses i andra genomföreningsstudier kan detta tillvägagångssätt generera varianter av okänd betydelse , särskilt när det används diagnostiskt.
Se även
- Komplex sjukdom
- Genomomfattande associationsstudie (GWAS)
- Microarray
- Helexomsekvensering (WES)
- Helgenomsekvensering (WGS)