Fluorinas
| Identifierare | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| för fluorinas (adenosylfluoridsyntas). | |||||||||
 | |||||||||
| EG nr. | 2.5.1.63 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
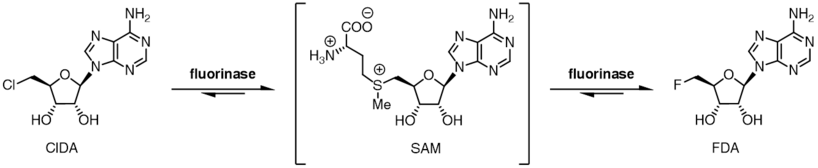
Fluorinasenzymet ( EC 2.5.1.63 , även känt som adenosylfluoridsyntas) katalyserar reaktionen mellan fluoridjonen och kofaktorn S -adenosyl-L-metionin för att generera L-metionin och 5' -fluoro-5'-deoxiadenosin , den första engagerade produkten av fluorometabolitbiosyntesvägen. Fluorinaset isolerades ursprungligen från jordbakterien Streptomyces cattleya , men homologer har sedan dess identifierats i ett antal andra bakteriearter, inklusive Streptomyces sp. MA37, Nocardia brasiliensis och Actinoplanes sp. N902-109. Detta är det enda kända enzymet som kan katalysera bildningen av en kol-fluorbindning, den starkaste enkelbindningen inom organisk kemi.

Ett homologt klorinasenzym , som katalyserar samma reaktion med klorid snarare än fluoridjon, har isolerats från Salinospora tropica , från den biosyntetiska vägen för salinosporamid A.
Reaktivitet
Fluorinaset katalyserar en nukleofil substitution av SN2-typ vid C-5'-positionen av SAM, medan L-metionin fungerar som en neutral lämnande grupp . Den fluorinaskatalyserade reaktionen uppskattas vara mellan 106 till 1015 gånger snabbare än den okatalyserade reaktionen, en betydande hastighetsökning. Trots detta betraktas fluorinaset fortfarande som ett långsamt enzym, med ett omsättningstal ( k cat ) på 0,06 min −1 . Den höga kinetiska barriären för reaktion tillskrivs den starka solvatiseringen av fluoridjoner i vatten, vilket resulterar i en hög aktiveringsenergi associerad med att avlägsna solvaterande vattenmolekyler från vattenhaltig fluoridjon, omvandla fluorid till en potent nukleofil inom det aktiva stället.
Reaktionen som katalyseras av fluorinaset är reversibel och vid inkubation av 5'-fluor-5'-deoxiadenosin och L-metionin med fluorinaset bildas SAM och fluoridjoner. Att ersätta L-metionin med L-selenometionin resulterar i en sexfaldig ökning av den omvända reaktionen på grund av selencentrets ökade nukleofilicitet jämfört med svavelcentret.
Fluorinaset uppvisar en grad av substrattolerans för halogenidjoner och kan även använda kloridjon i stället för fluoridjon. Medan jämvikten för reaktion mellan SAM och fluoridjon ligger mot produkterna FDA och L-metionin, är jämviktspositionen omvänd i fallet för kloridjon. Inkubation av SAM och kloridjon med fluorinaset resulterar inte i generering av 5'-klor-5'-deoxiadenosin (ClDA), såvida inte ett ytterligare enzym, ett L- aminosyraoxidas , tillsätts. Aminosyraoxidaset tar bort L-metioninet från reaktionen och omvandlar det till motsvarande oxosyra.

Halogenidpreferensen, kopplad till positionen för de två reaktionsjämvikterna, tillåter att en nettotranshalogeneringsreaktion katalyseras av enzymet. Inkubation av 5'-klornukleosider med enzymet tillsammans med katalytisk L-selenometionin eller L-metionin resulterar i produktion av 5-fluoro nukleosider. När [ 18F ]fluorid används kan denna transhalogeneringsreaktion användas för syntes av radiospårämnen för positronemissionstomografi .
Strukturstudier
I slutet av 2007 har 9 strukturer lösts för denna klass av enzymer, med PDB- accessionskoderna 1RQP , 1RQR , 2C2W , 2C4T , 2C4U , 2C5B , 2C5H , 2CBX och 2CC2 .
Namnen som ges till enzymet kommer inte från strukturen, utan från funktionen: 5-Fluoro-5-deoxiadenosin är den molekyl som syntetiseras. Strukturen är homolog med duf-62 enzymserien. Enzymet är en dimer av trimerer (2 molekyler vardera med tre subenheter). De aktiva platserna är belägna mellan dessa subenheter (subenhetsgränssnitt), var och en kan binda till en SAM-molekyl åt gången.