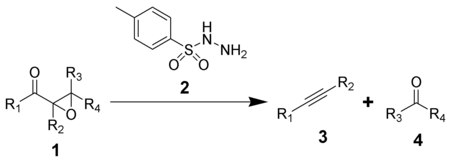
Eschenmoser fragmentering
Eschenmoser -fragmenteringen , som först publicerades 1967, är den kemiska reaktionen av α,β-epoxiketoner ( 1 ) med arylsulfonylhydraziner ( 2 ) för att ge alkyner ( 3 ) och karbonylföreningar ( 4 ). Reaktionen är uppkallad efter den schweiziska kemisten Albert Eschenmoser , som utarbetade den i samarbete med en industriell forskargrupp av Günther Ohloff , och använde den för produktion av muskon och relaterade makrocykliska mysker . Reaktionen är också ibland känd som Eschenmoser-Ohloff-fragmenteringen eller Eschenmoser-Tanabe-fragmenteringen eftersom Masato Tanabe oberoende publicerade en artikel om reaktionen samma år. Den allmänna formeln för fragmenteringen med användning av p- toluensulfonylhydrazid är:
Flera exempel finns i litteraturen och reaktionen utförs även i industriell skala.
Reaktionsmekanism
Mekanismen för Eschenmoser-fragmenteringen börjar med kondensationen av en α,β-epoxiketon ( 1 ) med en arylsulfonylhydrazin ( 2 ) för att ge den mellanliggande hydrazonen ( 3 ). Denna hydrazon kan antingen protoneras vid epoxidsyren eller deprotoneras vid sulfonamidkvävet för att initiera fragmenteringen, och sålunda katalyseras fragmenteringen av syror eller baser . De vanligaste reaktionstillstånden är dock behandling med ättiksyra i diklormetan . Protonöverföringen leder till intermediär ( 4 ), som genomgår nyckelfragmenteringen till alkyn ( 6 ) och motsvarande karbonylförening ( 7 ). Drivkraften för reaktionen är bildningen av mycket stabilt molekylärt kväve .
Det finns en radikal variant av denna fragmentering av α,β-enon till alkynon där ingen epoxid krävs. 1,3-Dibromo-5,5-dimetylhydantoin (DBDMH) i sek -butanol med lämplig p -tolylhydrazon har använts för att framställa exalton (cyklopentadekanon) och muscone (3-metyl- strukturanalogen ). Den α,β-omättade hydrazonen bromeras av DBDMH i allylpositionen (relativt till sulfonamidkvävet), vilket leder till en kaptodativt stabiliserad radikal, och bromidjonen blir den lämnande gruppen i den efterföljande nukleofila attacken av en alkoholatjon. Denna Fehr-Ohloff-Büchi- variant av Eschenmoser-Ohloff-fragramenteringen där ett epoxidationssteg undviks är lämpad för steriskt krävande substrat där låga utbyten vanligtvis är resultatet av klassisk Eschenmoser-fragmentering.
En närbesläktad fragmentering har rapporterats med användning av diazirinderivat av cykliska α,β-epoxiketoner.