CyaA
| Bifunktionellt hemolysin/adenylatcyklas | |||||||
|---|---|---|---|---|---|---|---|
 Schematisk representation av CyaA.
| |||||||
| Identifierare | |||||||
| Organism | |||||||
| Symbol | cya | ||||||
| Alt. symboler | cyaA | ||||||
| Entrez | 45387797 | ||||||
| RefSeq (Prot) | WP_010929995.1 | ||||||
| UniProt | P0DKX7 | ||||||
| Övriga uppgifter | |||||||
| EG-nummer | 4.6.1.1 | ||||||
| Kromosom | genom: 0,49 - 0,5 Mb | ||||||
| |||||||
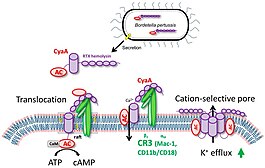
Adenylatcyklas-toxin ( CyaA ) frisätts från bakterien Bordetella pertussis av T1SS (Typ 1-sekretionssystem) och frisätts i värdens andningsvägar för att undertrycka dess tidiga medfödda och efterföljande adaptiva immunförsvar.
CyaA spelar en särskild roll i de tidiga faserna av luftvägskolonisering. Den kan omedelbart ta bort den bakteriedödande oxidativa explosionen, tillsammans med neutrofilers och makrofagers opsonofagocytiska dödande kapacitet . Som ett resultat möjliggör det etablering av Bordetella-infektion i luftvägsslemhinnan och främjar immunförsvaret av B. pertussis genom att påverka värdens immunceller.
Strukturera
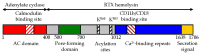
Toxinet är en 1706 rester lång polypeptid som består av ett N-terminalt ~400 rester långt adenylatcyklas (AC) enzym som är kopplat till en karakteristisk RTX hemolysin (Hly) del av ~1300 rester. Denna Hly-del består själv av fyra funktionella subdomäner, innefattande: (i) en hydrofob porbildande domän; (ii) en aktiveringsdomän, med de två posttranslationellt acylerade lysinresterna; (iii) en receptorbindande RTX-domän bestående av ~40 typiska kalciumbindande RTX-nonapeptidupprepningar]; och (iv) en icke-bearbetad C-terminal sekretionssignal som känns igen av ett bakteriellt typ I-sekretionssystem (T1SS), respektive.
Verkningssätt i värdceller
Väl i värdceller binder CyaA komplementreceptorn 3 (CR3), αMβ2-integrinet även känt som CD11b/CD18 eller Mac-1. Sedan translokerar toxinet sin AC-enzymdomän över det cytoplasmatiska membranet hos CR3 -uttryckande myeloidceller, såsom makrofager, neutrofiler och dendritiska celler.
Införande i cellens membran resulterar i ett inflöde av kalciumjoner som leder till en kalpainmedierad klyvning av talin . CyaA–CR3-komplexet omlokaliseras till lipidflottar och AC-domänen translokeras över cellmembranet till transmembranregionen, där signalkomplex, såsom proteinkinas A , är samlade.
Inuti cellerna binder AC-enzymet kalmodulin och katalyserar oreglerad omvandling av ATP till nyckelns andra budbärarmolekyl 3',5'-cykliskt adenosinmonofosfat (cAMP). cAMP är ansvarigt för inkapaciteringen av de bakteriedödande aktiviteterna hos målcellerna. RTX-hemolysindelen av CyaA är funktionellt oberoende av AC-domänen och bildar oligomera katjonselektiva porer som tillåter cytosoliska kaliumjoner att läcka från celler via cellmembranet.
Interferens med immunförsvaret
Den snabba produktionen av mycket höga nivåer av intracellulär cAMP i CD11b-uttryckande immunceller som möter CyaA, stör omedelbart de fysiologiska funktionerna hos fagocyter. I monocyter och makrofager blockerar den CyaA-producerade cAMP-signaleringen genom cAMP/proteinkinas A (PKA)-vägen produktionen av reaktiva syrearter (ROS). Detta stoppar också det komplementmedierade upptaget av opsoniserade partiklar. Vid högre CyaA-doser hämmas också FcR-medierad fagocytos.
Genom cAMP-signalering förändrar CyaA också TLR-utlöst mognad av dendritiska celler, hämmar proinflammatorisk IL-12- och TNF-α-utsöndring och förbättrar IL-10-produktion och Treg-expansion, vilket förhindrar induktion av adaptiva immunsvar mot Bordetella-infektioner.
Den enzymatiska AC-aktiviteten hos CyaA verkar också förlänga den intracellulära överlevnaden av icke-opsoniserade internaliserade (invaderande) B. pertussis-bakterier som går in i mänskliga och murina makrofager genom en icke-fagocytisk mekanism.
Se även
- ^ a b c d Fedele G, Schiavoni I, Adkins I, Klimova N, Sebo P (september 2017). "Invasion av dendritiska celler, makrofager och neutrofiler av Bordetella Adenylate Cyclase Toxin: A Subversive Move to Fool Host Immunity" . Toxiner . 9 (10): 293. doi : 10,3390/toxiner9100293 . PMC 5666340 . PMID 28934122 .
- ^ Novak J, Cerny O, Osickova A, Linhartova I, Masin J, Bumba L, et al. (september 2017). "Struktur-funktionsrelationer som ligger bakom kapaciteten hos Bordetella Adenylatcyklas-toxin att avväpna värdfagocyter" . Toxiner . 9 (10): 300. doi : 10,3390/toxiner9100300 . PMC 5666347 . PMID 28946636 .
- ^ a b Bumba L, Masin J, Fiser R, Sebo P (maj 2010). Bradley KA (red.). "Struktur-funktionsrelationer som ligger bakom förmågan hos Bordetella-adenylatcyklas-toxin att avväpna värdfagocyter" . PLOS Patogener . 6 (5): e1000901. doi : 10.1371/journal.ppat.1000901 . PMC 2869314 . PMID 20485565 .
- ^ a b Kamanova J, Kofronova O, Masin J, Genth H, Vojtova J, Linhartova I, et al. (oktober 2008). "Adenylatcyklas-toxin undergräver fagocytfunktionen genom RhoA-hämning och improduktiv ruggning" . Journal of Immunology . 181 (8): 5587–97. doi : 10.4049/jimmunol.181.8.5587 . PMID 18832717 .
- ^ Sebo P, Osicka R, Masin J (oktober 2014). "Adenylatcyklas toxin-hemolysin relevans för kikhostevacciner". Expertgranskning av vacciner . 13 (10): 1215–27. doi : 10.1586/14760584.2014.944900 . PMID 25090574 . S2CID 27038032 .