Mikrodialys
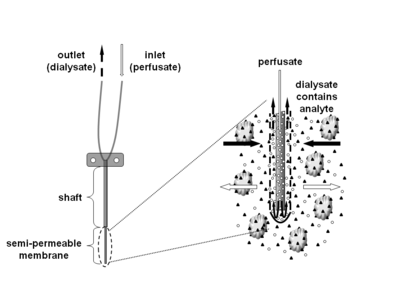
Mikrodialys är en minimalt invasiv provtagningsteknik som används för kontinuerlig mätning av fria, obundna analytkoncentrationer i den extracellulära vätskan i praktiskt taget vilken vävnad som helst. Analyter kan inkludera endogena molekyler (t.ex. neurotransmittorer , hormoner , glukos , etc.) för att bedöma deras biokemiska funktioner i kroppen, eller exogena föreningar (t.ex. läkemedel ) för att bestämma deras fördelning i kroppen. Mikrodialystekniken kräver införande av en liten mikrodialyskateter (även kallad mikrodialysprob) i vävnaden av intresse. Mikrodialyssonden är utformad för att efterlikna en blodkapillär och består av ett skaft med ett semipermeabelt ihåligt fibermembran i spetsen, som är anslutet till inlopps- och utloppsslangen. Sonden perfunderas kontinuerligt med en vattenlösning (perfusat) som nära liknar den (joniska) sammansättningen av den omgivande vävnadsvätskan vid en låg flödeshastighet på cirka 0,1-5μL/min. När de väl har införts i vävnaden eller (kropps)vätskan av intresse, kan små lösta ämnen passera det semipermeabla membranet genom passiv diffusion . Riktningen för analytflödet bestäms av respektive koncentrationsgradient och tillåter användning av mikrodialyssonder som provtagning och leveransverktyg. Lösningen som lämnar sonden (dialysat) samlas upp vid vissa tidsintervall för analys.
Historia
Mikrodialysprincipen användes först i början av 1960-talet, när push-pull-kanyler och dialyssäckar implanterades i djurvävnader, särskilt i gnagarhjärnor, för att direkt studera vävnadernas biokemi. Även om dessa tekniker hade ett antal experimentella nackdelar, såsom antalet prover per djur eller ingen/begränsad tidsupplösning, hjälpte uppfinningen av kontinuerligt perfunderade dialytroder 1972 till att övervinna några av dessa begränsningar. Ytterligare förbättringar av dialytrodkonceptet resulterade i uppfinningen av "hålfibern", ett rörformigt semipermeabelt membran med en diameter på ~200-300μm, 1974. Dagens mest utbredda form, nålsonden, består av ett skaft med en ihålig fiber vid dess spets och kan föras in med hjälp av en styrkanyl i hjärnan och andra vävnader. En alternativ metod, open flow micro-perfusion (OFM), ersätter membranet med makroskopiska öppningar som underlättar provtagning av lipofila och hydrofila föreningar, proteinbundna och obundna läkemedel, neurotransmittorer , peptider och proteiner , antikroppar , nanopartiklar och nanobärare , enzymer och vesiklar .
Mikrodialyssonder
Det finns en mängd olika sonder med olika kombinationer av membran och skaftlängder tillgängliga. Molekylviktsgränsen för kommersiellt tillgängliga mikrodialyssonder täcker ett brett intervall av cirka 6-100 kD, men även 1MD är tillgängligt. Medan vattenlösliga föreningar i allmänhet diffunderar fritt över mikrodialysmembranet, är situationen inte lika tydlig för höglipofila analyter, där både framgångsrika (t.ex. kortikosteroider) och misslyckade mikrodialysexperiment (t.ex. östradiol, fusidinsyra) har rapporterats. Utvinningen av vattenlösliga föreningar minskar emellertid vanligtvis snabbt om analytens molekylvikt överstiger 25 % av membranets molekylviktsgräns.
Återställnings- och kalibreringsmetoder
På grund av den konstanta perfusionen av mikrodialysproben med färskt perfusat kan en total jämvikt inte fastställas. Detta resulterar i dialysatkoncentrationer som är lägre än de som uppmäts vid den avlägsna provtagningsplatsen. För att korrelera uppmätta koncentrationer i dialysatet med de som finns på den avlägsna provtagningsplatsen behövs en kalibreringsfaktor (återvinning). Återvinningen kan bestämmas vid steady-state med användning av den konstanta hastigheten för analytutbyte över mikrodialysmembranet. Hastigheten med vilken en analyt byts ut över det semipermeabla membranet uttrycks i allmänhet som analytens extraktionseffektivitet. Extraktionseffektiviteten definieras som förhållandet mellan förlust/vinst av analyt under dess passage genom sonden (C in -C out ) och skillnaden i koncentration mellan perfusat och avlägsna provtagningsställe (C in -C prov ).
I teorin kan extraktionseffektiviteten för en mikrodialysprob bestämmas genom att: 1) ändra läkemedelskoncentrationerna samtidigt som flödeshastigheten hålls konstant eller 2) ändra flödeshastigheten samtidigt som de respektive läkemedelskoncentrationerna hålls konstanta. Vid steady-state erhålls samma extraktionseffektivitetsvärde, oavsett om analyten är anrikad eller utarmad i perfusatet. Mikrodialyssonder kan följaktligen kalibreras genom att antingen mäta förlusten av analyt med användning av läkemedelsinnehållande perfusat eller ökningen av analyt med användning av läkemedelsinnehållande provlösningar. Hittills är de mest använda kalibreringsmetoderna lågflödesmetoden, no-net-flux-metoden, den dynamiska (utvidgade) no-net-flux-metoden och retrodialysmetoden. Det korrekta valet av en lämplig kalibreringsmetod är avgörande för framgången av ett mikrodialysexperiment. Stödjande in vitro -experiment före användning på djur eller människor rekommenderas därför. Dessutom kan återhämtningen som bestäms in vitro skilja sig från återhämtningen hos människor. Dess faktiska värde måste därför bestämmas i varje in vivo-experiment.
Lågflödesmetod
Lågflödesmetoden bygger på att utsugningseffektiviteten är beroende av flödet. Vid höga flödeshastigheter är mängden läkemedel som diffunderar från provtagningsstället in i dialysatet per tidsenhet mindre (låg extraktionseffektivitet) än vid lägre flödeshastigheter (hög extraktionseffektivitet). Vid en flödeshastighet på noll etableras en total jämvikt mellan dessa två platser (Cout = C sample ). Detta koncept tillämpas för metoden med (låg)flödeshastighet, där sonden perfunderas med blankperfusat vid olika flödeshastigheter. Koncentrationen vid provtagningsplatsen kan bestämmas genom att plotta extraktionsförhållandena mot motsvarande flödeshastigheter och extrapolera till nollflöde. Metoden med låg flödeshastighet begränsas av det faktum att kalibreringstiderna kan vara ganska långa innan en tillräcklig provvolym har samlats in. [ citat behövs ]
No-net-flux-metod
Under kalibrering med no-net-flux-metoden perfunderas mikrodialyssonden med minst fyra olika koncentrationer av analyten av intresse (C in ) och steady-state-koncentrationer av analyten som lämnar sonden mäts i dialysatet (C ut ). Återvinningen för denna metod kan bestämmas genom att plotta C ut −C in över C in och beräkna lutningen för regressionslinjen. Om analytkoncentrationerna i perfusatet är lika med koncentrationerna vid provtagningsstället uppstår inget nettoflöde. Respektive koncentrationer vid no-net-fluxpunkten representeras av regressionslinjens x-avsnitt. Styrkan med denna metod är att, vid steady-state, inga antaganden om föreningens beteende i närheten av sonden behöver göras, eftersom jämvikt existerar vid en specifik tid och plats. Under övergående förhållanden (t.ex. efter läkemedelsutmaning) kan emellertid probens återhämtning förändras vilket resulterar i partiska uppskattningar av koncentrationerna vid provtagningsstället. För att övervinna denna begränsning har flera tillvägagångssätt utvecklats som också är tillämpliga under icke-stabila förhållanden. Ett av dessa tillvägagångssätt är den dynamiska no-net-flux-metoden.
Dynamisk no-net-flux-metod
Medan ett enda försöksperson/djur genomsyras av flera koncentrationer under no-net-flux-metoden, genomsyras flera försökspersoner med en enda koncentration under den dynamiska no-net-flux-metoden (DNNF). Data från de olika försökspersonerna/djuren kombineras sedan vid varje tidpunkt för regressionsanalys, vilket möjliggör bestämning av återhämtningen över tiden. Utformningen av DNNF-kalibreringsmetoden har visat sig vara mycket användbar för studier som utvärderar responsen hos endogena föreningar, såsom neurotransmittorer, på läkemedelsutmaning.
Retrodialys
Under retrodialys perfunderas mikrodialyssonden med en analytinnehållande lösning och försvinnandet av läkemedel från sonden övervakas. Återvinningen för denna metod kan beräknas som förhållandet mellan läkemedel som förloras under passage (C in -C out ) och läkemedel som kommer in i mikrodialyssonden (C in ). I princip kan retrodialys utföras med antingen själva analyten (retrodialys med läkemedel) eller en referensförening (retrodialys med kalibrator) som nära liknar analytens fysiokemiska och biologiska egenskaper. Trots det faktum att retrodialys med läkemedel inte kan användas för endogena föreningar eftersom det kräver frånvaro av analyt från provtagningsstället, används denna kalibreringsmetod oftast för exogena föreningar i kliniska miljöer.
Ansökningar
Mikrodialystekniken har genomgått mycket utveckling sedan den första gången användes 1972, då den först användes för att övervaka koncentrationer av endogena biomolekyler i hjärnan. Dagens användningsområde har utökats till att övervaka fria koncentrationer av endogena såväl som exogena föreningar i praktiskt taget vilken vävnad som helst. Även om mikrodialys fortfarande främst används i prekliniska djurstudier (t.ex. laboratoriegnagare, hundar, får, grisar), används den nu alltmer hos människor för att övervaka koncentrationer av fria, obundna läkemedelsvävnader samt interstitiell koncentration av regulatoriska cytokiner och metaboliter som svar på homeostatiska störningar såsom matning och/eller träning.
När den används i hjärnforskning, används mikrodialys vanligtvis för att mäta signalsubstanser (t.ex. dopamin , serotonin , noradrenalin , acetylkolin , glutamat , GABA ) och deras metaboliter, såväl som små neuromodulatorer (t.ex. cAMP , cGMP , NO ), aminosyror (t.ex. glycin ). cystein , tyrosin ) och energisubstrat (t.ex. glukos , laktat , pyruvat ) . Exogena läkemedel som ska analyseras med mikrodialys inkluderar nya antidepressiva medel , antipsykotika , såväl som antibiotika och många andra läkemedel som har sin farmakologiska effekt i hjärnan. Den första icke-metaboliten som analyserades genom mikrodialys in vivo i den mänskliga hjärnan var rifampicin .
Tillämpningar i andra organ inkluderar huden (bedömning av biotillgänglighet och bioekvivalens av topiskt applicerade dermatologiska läkemedelsprodukter) och övervakning av glukoskoncentrationer hos patienter med diabetes (intravaskulär eller subkutan sondplacering). Det senare kan till och med inkorporeras i ett artificiellt pankreassystem för automatiserad insulinadministrering.
Mikrodialys har också funnit ökande tillämpning inom miljöforskning, provtagning av en mängd olika föreningar från avloppsvatten och jordlösningar, inklusive sackarider, metalljoner, mikronäringsämnen, organiska syror och lågmolekylärt kväve. Med tanke på den destruktiva naturen hos konventionella jordprovtagningsmetoder har mikrodialys potential att uppskatta flöden av jordjoner som bättre återspeglar en ostörd jordmiljö.
Kritisk analys
Fördelar
- Hittills är mikrodialys den enda provtagningstekniken in vivo som kontinuerligt kan övervaka läkemedels- eller metabolitkoncentrationer i den extracellulära vätskan i praktiskt taget vilken vävnad som helst. Beroende på den exakta tillämpningen kan analytkoncentrationer övervakas under flera timmar, dagar eller till och med veckor. Koncentrationer av fri, obunden extracellulär vävnad är i många fall av särskilt intresse eftersom de liknar farmakologiskt aktiva koncentrationer vid eller nära verkningsstället. Kombination av mikrodialys med modern avbildningsteknik, såsom positronemissionstomografi , möjliggör ytterligare bestämning av intracellulära koncentrationer.
- Införande av sonden på en exakt plats av den utvalda vävnaden möjliggör vidare utvärdering av extracellulära koncentrationsgradienter på grund av transportöraktivitet eller andra faktorer, såsom perfusionsskillnader. Det har därför föreslagits som den mest lämpliga tekniken att användas för vävnadsfördelningsstudier.
- Utbyte av analyt över det semipermeabla membranet och konstant ersättning av provtagningsvätskan med färskt perfusat förhindrar dränering av vätska från provtagningsplatsen, vilket möjliggör provtagning utan vätskeförlust. Mikrodialys kan följaktligen användas utan att störa vävnadsförhållandena genom lokal vätskeförlust eller tryckartefakter, vilket kan uppstå vid användning av andra tekniker, såsom mikroinjektion eller push-pull perfusion.
- Det semipermeabla membranet förhindrar celler, cellrester och proteiner från att komma in i dialysatet. På grund av bristen på protein i dialysatet behövs ingen provsanering före analys och enzymatisk nedbrytning är inte ett problem.
Begränsningar
- Trots vetenskapliga framsteg när det gäller att göra mikrodialyssonder mindre och mer effektiva, innebär den invasiva karaktären hos denna teknik fortfarande några praktiska och etiska begränsningar. Till exempel har det visat sig att implantation av en mikrodialysprob kan förändra vävnadsmorfologin vilket resulterar i störd mikrocirkulation, metabolismhastighet eller integritet hos fysiologiska barriärer, såsom blod-hjärnbarriären . Även om akuta reaktioner på sondinsättning, såsom implantationstrauma, kräver tillräcklig återhämtningstid, måste ytterligare faktorer, såsom nekros , inflammatoriska svar eller sårläkningsprocesser tas i beaktande vid långtidsprovtagning eftersom de kan påverka det experimentella resultatet. Ur ett praktiskt perspektiv har det föreslagits att utföra mikrodialysexperiment inom ett optimalt tidsfönster, vanligtvis 24–48 timmar efter sondinsättning.
- Mikrodialys har en relativt låg temporal och rumslig upplösning jämfört med till exempel elektrokemiska biosensorer . Medan den tidsmässiga upplösningen bestäms av längden på provtagningsintervallen (vanligtvis några minuter), bestäms den rumsliga upplösningen av sondens dimensioner. Sondens storlek kan variera mellan olika användningsområden och täcker ett intervall på några millimeter (intracerebral applicering) upp till några centimeter ( subkutan applicering) i längd och några hundra mikrometer i diameter. [ citat behövs ]
- Tillämpningen av mikrodialystekniken begränsas ofta av bestämningen av probens återhämtning, särskilt för in vivo- experiment. Bestämning av återhämtningen kan vara tidskrävande och kan kräva ytterligare försökspersoner eller pilotexperiment. Återvinningen är till stor del beroende av flödet: ju lägre flöde desto högre återvinning. Men i praktiken kan flödeshastigheten inte minskas för mycket eftersom antingen provvolymen som erhålls för analys kommer att vara otillräcklig eller experimentets tidsmässiga upplösning kommer att gå förlorad. Det är därför viktigt att optimera förhållandet mellan flödeshastighet och den analytiska analysens känslighet. Situationen kan vara mer komplex för lipofila föreningar eftersom de kan fastna på slangen eller andra sondkomponenter, vilket resulterar i låg eller ingen analytåtervinning. [ citat behövs ]