Catenin alfa-1
| CTNNA1 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
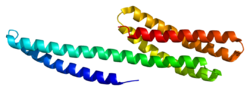 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , CAP102, Catenin, MDPT2, Catenin alpha 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa IDs | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
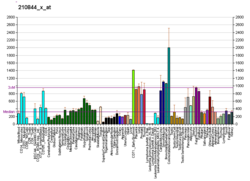
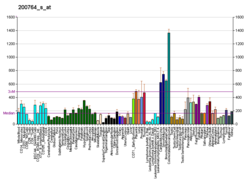
αE-catenin , även känt som Catenin alfa-1, är ett protein som hos människor kodas av CTNNA1- genen . αE-catenin uttrycks i hög grad i hjärtmuskeln och lokaliseras till adherensövergångar vid interkalerade diskstrukturer där det fungerar för att förmedla förankringen av aktinfilament till sarkolemma . αE-catenin spelar också en roll i tumörmetastaser och hudcellsfunktion.
Strukturera
Humant αE-cateninprotein är 100,0 kDa och 906 aminosyror . Kateniner (α,β och γ (även känd som plakoglobin ) ) identifierades ursprungligen i komplex med E-cadherin , ett epitelcellsadhesionsprotein . αE-catenin uttrycks i hög grad i hjärtmuskeln och är homologt med proteinet vinkulin ; emellertid, bortsett från vinkulin , har aE-catenin ingen homologi med etablerade aktinbindande proteiner. N -terminalen av αE-catenin binder β-catenin eller y-catenin/plakoglobin, och C-terminalen binder aktin direkt eller indirekt via vinkulin eller α-aktinin .
Fungera
Även om αE-catenin uppvisar betydande uttryck i hjärtmuskeln , är αE-catenin mest välkänt för sin roll i metastaserande tumörceller. αE-catenin spelar också en roll i epitelvävnad , både vid adherens-korsningar och i signalvägar.
I kardiomyocyter är αE-catenin närvarande i cell-till-cell-regioner som är kända som adherens-övergångar som ligger inuti interkalerade skivor ; dessa förbindelser förankrar aktincytoskelettet till sarkolemma och ger stark cellvidhäftning.
Funktionellt αE-catenin krävs för normal embryonal utveckling, eftersom en mutation som eliminerar den C-terminala 1/3 av proteinet , vilket resulterar i en fullständig funktionsförlust fenotyp, visade störningar av trofoblastepitelet och stoppade utvecklingen i blastocyststadiet .
αE-catenin specifikt, inte β- eller γ-catenin, binder F-aktin och organiserar och binder filamenten vid regioner av cell-cellkontakt. Studier visar att αE-catenin i full längd binder och buntar F-aktin på ett överlägset sätt jämfört med individuella N-terminala eller C-terminala domäner.
αE-catenin bildar tillsammans med β-catenin och plakoglobin distinkta komplex med N-cadherin som är involverade i att bilda cell-cell-kontakter och differentiering av kardiomyocyter . Catenin-N-cadherin-komplex är uppenbarligen nödvändiga för och föregår den första cell-till-cell-kontakten, föregångare till gap junction- bildning. Förankringen av cadherin-catenin-komplex till aktinfilament av αE-catenin regleras av tyrosinfosforylering .
Funktionella insikter om αE-cateninfunktion har kommit från studier som använder transgenes. Möss som hyser en hjärtspecifik deletion av αE-catenin uppvisade abnormiteter i hjärtdimensioner och funktion, representativa för dilaterad kardiomyopati . Detta kännetecknades ytterligare av desorganisering av interkalerade diskstrukturer och mitokondrier , såväl som kompenserande ökningar av β-catenin och minskningar i lokalisering av cadherin och vinkulin vid interkalerade diskar . Knockout-möss uppvisade också hög känslighet för dödsfall efter stress.
Klinisk signifikans
Interaktioner
αE-catenin har visats interagera med:
- APC ,
- Beta-catenin ,
- CDH1 ,
- CDH2 ,
- CDH3
- Plakoglobin och
- VE-cadherin .
Se även
Vidare läsning
- Nagafuchi A, Takeichi M, Tsukita S (1991). "Det 102 kd cadherin-associerade proteinet: likhet med vinkulin och posttranskriptionell reglering av uttryck". Cell . 65 (5): 849–57. doi : 10.1016/0092-8674(91)90392-C . PMID 1904011 . S2CID 38622586 .
- Kinch MS, Clark GJ, Der CJ, Burridge K (1995). "Tyrosinfosforylering reglerar vidhäftningen av ras-transformerade bröstepitel" . J. Cell Biol . 130 (2): 461–71. doi : 10.1083/jcb.130.2.461 . PMC 2199929 . PMID 7542250 .
- Sacco PA, McGranahan TM, Wheelock MJ, Johnson KR (1995). "Identifiering av plakoglobindomäner som krävs för association med N-cadherin och alfa-catenin" . J. Biol. Chem . 270 (34): 20201–6. doi : 10.1074/jbc.270.34.20201 . PMID 7650039 .
- Daniel JM, Reynolds AB (1995). "Tyrosinkinassubstratet p120cas binder direkt till E-cadherin men inte till det adenomatösa polyposis coli-proteinet eller alfa-catenin" . Mol. Cell. Biol . 15 (9): 4819–24. doi : 10.1128/mcb.15.9.4819 . PMC 230726 . PMID 7651399 .
- Aberle H, Butz S, Stappert J, Weissig H, Kemler R, Hoschuetzky H (1995). "Montering av cadherin-catenin-komplexet in vitro med rekombinanta proteiner". J. Cell Sci . 107 (12): 3655–63. doi : 10.1242/jcs.107.12.3655 . PMID 7706414 .
- Knudsen KA, Soler AP, Johnson KR, Wheelock MJ (1995). "Interaktion av alfa-aktinin med cadherin/catenin cell-celladhesionskomplex via alfa-catenin" . J. Cell Biol . 130 (1): 67–77. doi : 10.1083/jcb.130.1.67 . PMC 2120515 . PMID 7790378 .
- Rimm DL, Kebriaei P, Morrow JS (1994). "Molekylär kloning avslöjar alternativa splitsningsformer av humant alfa(E)-catenin" . Biochem. Biophys. Res. Commun . 203 (3): 1691–9. doi : 10.1006/bbrc.1994.2381 . PMID 7945318 .
- Oyama T, Kanai Y, Ochiai A, Akimoto S, Oda T, Yanagihara K, Nagafuchi A, Tsukita S, Shibamoto S, Ito F (1994). "Ett trunkerat beta-catenin stör interaktionen mellan E-cadherin och alfa-catenin: en orsak till förlust av intercellulär vidhäftning i mänskliga cancercellinjer". Cancer Res . 54 (23): 6282–7. PMID 7954478 .
- McPherson JD, Morton RA, Ewing CM, Wasmuth JJ, Overhauser J, Nagafuchi A, Tsukita S, Isaacs WB (1994). "Tilldelning av den humana alfa-cateningenen (CTNNA1) till kromosom 5q21-q22" . Genomik . 19 (1): 188–90. doi : 10.1006/geno.1994.1042 . PMID 8188230 .
- Su LK, Vogelstein B, Kinzler KW (1994). "Association av APC-tumörsuppressorproteinet med kateniner". Vetenskap . 262 (5140): 1734–7. doi : 10.1126/science.8259519 . PMID 8259519 .
- Oda T, Kanai Y, Shimoyama Y, Nagafuchi A, Tsukita S, Hirohashi S (1993). "Kloning av humant alfa-catenin cDNA och dess avvikande mRNA i en human cancercellinje". Biochem. Biophys. Res. Commun . 193 (3): 897–904. doi : 10.1006/bbrc.1993.1710 . PMID 8323564 .
- Furukawa Y, Nakatsuru S, Nagafuchi A, Tsukita S, Muto T, Nakamura Y, Horii A (1993). "Struktur, uttryck och kromosomtilldelning av human catenin (cadherin-associerat protein) alfa 1 gen (CTNNA1)". Cytogenet. Cell Genet . 65 (1–2): 74–8. doi : 10.1159/000133603 . PMID 8404069 .
- Obama H, Ozawa M (1997). "Identifiering av domänen av alfa-catenin involverad i dess association med beta-catenin och plakoglobin (gamma-catenin)" . J. Biol. Chem . 272 (17): 11017–20. doi : 10.1074/jbc.272.17.11017 . PMID 9110993 .
- Linkels M, Bussemakers MJ, Nollet F, Ewing CM, van Roy F, Schalken JA (1997). "Molekylär kloning av ett alternativt humant alfaE-catenin cDNA". Biochem. Biophys. Res. Commun . 237 (1): 177–81. doi : 10.1006/bbrc.1997.7058 . PMID 9266853 .
- Lewalle JM, Bajou K, Desreux J, Mareel M, Dejana E, Noël A, Foidart JM (1998). "Förändring av interendotelial adherens junctions efter interaktion mellan tumörceller och endotelceller in vitro". Exp. Cell Res . 237 (2): 347–56. doi : 10.1006/excr.1997.3799 . hdl : 2268/61990 . PMID 9434630 .
- Reuver SM, Garner CC (1998). "E-cadherin-medierad celladhesion rekryterar SAP97 till det kortikala cytoskelettet". J. Cell Sci . 111 (8): 1071–80. doi : 10.1242/jcs.111.8.1071 . PMID 9512503 .
- Watabe-Uchida M, Uchida N, Imamura Y, Nagafuchi A, Fujimoto K, Uemura T, Vermeulen S, van Roy F, Adamson ED, Takeichi M (1998). "alfa-Catenin-vinkulin interaktion fungerar för att organisera det apikala junctional komplexet i epitelceller" . J. Cell Biol . 142 (3): 847–57. doi : 10.1083/jcb.142.3.847 . PMC 2148175 . PMID 9700171 .
- Roe S, Koslov ER, Rimm DL (1998). "En mutation i alfa-catenin stör vidhäftningen i klon A-celler utan att störa dess aktin- och beta-cateninbindande aktivitet" . Cell vidhäftar. Commun . 5 (4): 283–96. doi : 10.3109/15419069809040298 . PMID 9762469 .
- Itoh M, Morita K, Tsukita S (1999). "Karakterisering av ZO-2 som en MAGUK-familjemedlem förknippad med täta såväl som adherens-övergångar med en bindande affinitet till occludin och alfa-catenin" . J. Biol. Chem . 274 (9): 5981–6. doi : 10.1074/jbc.274.9.5981 . PMID 10026224 .