Variant ytglykoprotein
| Variabla | |
|---|---|
| ytglykoproteinidentifierare | |
| Organism | |
| Symbol | Tb927.5.4730 |
| Alt. symboler | Tb05.26C7.380 |
| Entrez | 3657576 |
| Övriga uppgifter | |
| Kromosom | 5: 1,41 - 1,41 Mb |
| Variant ytglykoprotein MITAT 1.2 | |||||||
|---|---|---|---|---|---|---|---|
| Identifierare | |||||||
| Organism | |||||||
| Symbol | N/A | ||||||
| Alt. symboler | VSG 221 | ||||||
| UniProt | P26332 | ||||||
| |||||||
Variant ytglykoprotein ( VSG ) är ett ~ 60kDa protein som tätt packar cellytan på protozoparasiter som tillhör släktet Trypanosoma . Detta släkte är anmärkningsvärt för sina cellyteproteiner. De isolerades först från Trypanosoma brucei 1975 av George Cross . VSG tillåter trypanosomatidparasiterna att undvika däggdjursvärdens immunsystem genom omfattande antigen variation . De bildar en ytbeläggning på 12–15 nm. VSG-dimerer, ~90% av allt cellytprotein. Det utgör också ~10% av det totala cellproteinet. Av denna anledning är dessa proteiner mycket immunogena och ett immunsvar mot en specifik VSG-hölje kommer snabbt att döda trypanosomer som uttrycker denna variant. Men med varje celldelning finns det en möjlighet att avkomman kommer att byta uttryck för att ändra VSG som uttrycks. VSG har ingen föreskriven biokemisk aktivitet.
Parasiten har en stor cellulär repertoar av antigeniskt distinkta VSGs (~1500/2000 [ citat behövs ] fullständiga och partiella ( pseudogenes )) lokaliserade i telomera och subtelomera arrayer (på megabaskromosomer eller minkromosomer ). VSG uttrycks från ett blodomloppsuttrycksställe (BES, ES) i en polycistron av RNA-polymeras I (rekryterad till en promotor av ribosomaltyp ) med andra ES-associerade gener (ESAGs), varav transferrinreceptor (Tfr: ESAG6, ESAG7) är en. Endast en VSG-gen uttrycks åt gången, eftersom endast en av ~15 ES är aktiv i en cell. VSG-uttryck "växlas" genom homolog rekombination av en tyst basgen kopia från en array (styrd av homologi) till det aktiva telomeriskt belägna uttrycksstället. Under denna övergång visar trypanosomer samtidigt både pre- och post-switch VSGs på sin yta. Denna pälsbytesprocess är avgörande för överlevnaden av nyligen bytta celler eftersom initiala VSG:er förblir mål för det eskalerande värd-Ab-svaret. Mosaiska VSG-gener kan skapas genom homolog rekombination av en partiell VSG-gen från en array. Denna partiella gen kan ersätta vilken del som helst av den kvarvarande VSG-genen, vilket skapar en ny mosaik-VSG. VSG-halveringstidsmätningar tyder på att initiala VSG:er kan kvarstå på ytan av genetiskt byta trypanosomer i flera dagar. Det är fortfarande oklart om regleringen av VSG-växling är rent stokastisk eller om miljöstimuli påverkar växlingsfrekvensen. Det faktum att byte sker in vitro antyder att det finns åtminstone något värdoberoende, stokastiskt element i processen.
Den antigena variationen orsakar cykliska vågor av parasitemi, vilket är ett av kännetecknen för mänsklig afrikansk trypanosomiasis . Den cykliska processen tar 5–8 dagar. Detta beror på att en mångfald av pälsar som uttrycks av trypanosompopulationen innebär att immunsystemet alltid ligger ett steg efter: det tar flera dagar för ett immunsvar mot en given VSG att utvecklas, vilket ger populationen tid att diversifiera sig när individer genomgår ytterligare byten. evenemang. Upprepningen av denna process förhindrar utrotningen av den infekterande trypanosompopulationen, vilket tillåter kronisk persistens av parasiter i värden och förbättrar möjligheterna för överföring.
I Trypanosoma brucei
I Trypanosoma brucei är cellytan täckt av en tät beläggning av ~5 x 106 VSG - dimerer , ~90% av allt cellytprotein. Det utgör också ~10% av det totala cellproteinet.
Egenskaperna hos VSG-pälsen som möjliggör immunundandragande är:
- Avskärmning – den täta naturen hos VSG-pälsen (VSG-proteiner packar skuldra till axel) hindrar däggdjursvärdens immunsystem från att komma åt plasmamembranet eller andra parasitiska invarianta ytepitoper (såsom jonkanaler , transportörer , receptorer etc.) . ). Pälsen är enhetlig och består av miljontals kopior av samma molekyl; därför är VSG den enda delen av trypanosomen som immunsystemet kan känna igen.
- Periodisk antigen variation – VSG-pälsen genomgår frekvent stokastisk genetisk modifiering - "byte" - vilket gör att varianter som uttrycker en ny VSG-päls undslipper det specifika immunsvaret som uppstår mot den tidigare pälsen. Denna antigena variation skapar cykliska vågor av parasitemi som är karakteristiska för mänsklig afrikansk trypanosomiasis.
- Antigen "rengöring" och VSG-återvinning – VSG återvinns effektivt genom trypanosomens flagellficka, vilket gör att antikroppar kan "rensas" från VSG innan de återinkorporeras tillbaka i cellmembranet. Viktigt är att VSG som känns igen och binds av antikroppar selektivt skjuts mot flagellfickan i en snabbare takt än oidentifierad VSG; i detta scenario fungerar antikroppen som ett "segel", vilket påskyndar processen med att VSG förs till återvinningsområdet.
VSG:erna från T. brucei är fästa vid plasmamembranet via en kovalent anslutning till två glykosyl-fosfatidylinositol (GPI) ankare (en per monomer ), som riktar dess framåtriktade trafik från ER till flagellfickan för inkorporering i membranet, som förutspåtts av GPI-valenshypotesen.
VSG ersätts av ett lika tätt lager av procykliner när parasiten differentierar till den procykliska formen i tsetseflugans mellantarm. Det finns en mycket snabb hämning av VSG-gentranskription som sker så snart temperaturen sänks.
Uttryck
Källan till VSG-variabilitet under infektion är ett stort "arkiv" av VSG -gener som finns i T. brucei- genomet . Några av dessa är intakta gener i full längd ; andra är pseudogener (typiskt med ramförskjutningsmutationer , prematura stoppkodoner eller fragmentering). Expression av en antigeniskt annorlunda VSG kan ske genom att helt enkelt byta till en annan fullängds VSG- gen genom Expression Site-byte (växling av vilken ES som är aktiv). Dessutom chimära eller "mosaik" VSG -gener genereras genom att kombinera segment från mer än en tyst VSG- gen. Bildandet av mosaik VSG s tillåter (partiellt) uttryck av pseudogen VSG s, som kan utgöra huvuddelen av VSG arkivet, och kan bidra direkt till antigen variation, vilket avsevärt ökar trypanosomens förmåga att undvika immunförsvar och utgör ett stort problem för utveckling av vaccin .
VSG- gener kan hållas tysta och slås på när som helst. Det uttryckta VSG är alltid lokaliserat i ett uttrycksställe (ES), som är specialiserade uttrycksställen som finns vid telomererna i några av de stora och mellanliggande kromosomerna. Varje ES är en polycistronisk enhet, som innehåller ett antal Expression Site-Associated Genes (ESAG) som alla uttrycks tillsammans med den aktiva VSG. Medan flera ES finns, är bara en enda aktiv på en gång. Ett antal mekanismer verkar vara inblandade i denna process, men den exakta karaktären av tystnaden är fortfarande oklart.
Det uttryckta VSG kan bytas antingen genom att aktivera ett annat uttrycksställe (och därmed ändra för att uttrycka VSG på det stället), eller genom att ändra VSG- genen i det aktiva stället till en annan variant. Genomet innehåller många kopior av VSG-gener, både på minkromosomer och i upprepade sektioner i det inre av kromosomerna. Dessa är i allmänhet tysta, vanligtvis med utelämnade sektioner eller för tidigt stoppkodon, men är viktiga i utvecklingen av nya VSG-gener. Det uppskattas att upp till 10% av T.brucei -genomet kan utgöras av VSG-gener eller pseudogener . Vilken som helst av dessa gener kan flyttas in i det aktiva stället genom rekombination för uttryck. Återigen, de exakta mekanismerna som styr detta är oklara, men processen verkar förlita sig på DNA-reparationsmaskiner och en process av homolog rekombination .
Blodströmsuttrycksstället (BES), eller telomert uttrycksställe, används för att utbyta varianter av ytglykoproteiner när de befinner sig i värdens blodström för att undkomma komplementsystemet . BES är polymorfa i storlek och struktur men avslöjar en överraskande bevarad arkitektur i samband med omfattande rekombination. Mycket små BES existerar och många fungerande BES innehåller inte det fullständiga komplementet av expressionsplatsassocierade gener ( ESAG). Det finns en samling på uppskattningsvis 20-30 sajter, som var och en är aktiv åt gången. Aktiva VSG-expressionsställen är utarmade på nukleosomer .
Genrepertoarerna i T. brucei har divergerat för att bli stamspecifika.
Varierande ytglykoproteingener av T. brucei har klassificerats i två grupper beroende på om duplicering av generna observeras eller inte när de uttrycks.
Sekreterarhandel
Trypanosoma har ett enkelt, polariserat membrantransportsystem som består av en enda ER , lysosom och Golgi-apparat .
VSG transkriberas först som en polycistron och genomgår sedan trypanosomatid-specifik polyadenylering och trans-splitsning styrd av polypyrimidin-kanaler . Eftersom det inte finns någon transkriptionskontroll är VSG 3'UTR viktig för dess RNA-stabilitet (viktigast av allt, 8mer och 14mer). VSG transkriberas sedan på membranbundna polysomer , och uppkomsten av den N-terminala signalsekvensen leder VSG till ER. VSG transporteras därigenom co-translationellt in i ER-lumen, snabbt N-glykosyleras (på asn-x-ser/thr-ställen) och GPI förankras vid ω-stället genom en transamineringsreaktion (avlägsnande av C-termen hydrofoba 17 eller 23 aa GPI-förankringssekvens). ω-stället är alltid Ser (vanligtvis i 17 aa signalsekvenspeptider), Asp (vanligtvis i 23 aa signalsekvenspeptider) eller Asn. Dessutom kan antalet N-glykosyleringsställen per VSG variera (vanligtvis 1-3 N-glykaner). VSG MITat.1.5 glykosyleras vid alla tre potentiella N-glykosyleringsställen.
VSG genomgår sedan calreticulin / calnexin -vikningscykeln (calnexin saknas i Trypanosoma brucei ), där det övergående monoglukosyleras och deglukosyleras och interagerar med olika ER-chaperoneproteiner, såsom BiP, för att vika sig korrekt. VSG viker och dimeriserar effektivt (vilket tyder på i sig gynnsam vikning) och transporteras genom Golgi till flagellfickan för inkorporering i cellmembranet.
Viktigt, efter inkorporering i cellmembranet, kan VSG senare återvinnas genom flagellfickan och sorteras tillbaka till cellytan. VSG omvandlas inte av lysosomala eller proteasomala kanoniska nedbrytningsvägar, utan förloras istället från cellen genom specifik klyvning av dess GPI-ankare genom GPI-specifik PLC .
Strukturera
VSG-gener är enormt variabla på sekvensnivå (primär), men varianter tros ha starkt konserverade strukturella (tertiära) egenskaper, baserat på två bestämda 3-dimensionella strukturer och bevarande av 2-dimensionella sekvensmotiv (fallande och stigande alfa-helixer) som utgör dimeriseringsgränssnittet), vilket gör att de kan utföra en liknande skärmningsfunktion. VSGs består av en N-terminal domän på cirka 300-350 aminosyror med låg sekvenshomologi (13-30% identitet), och en mer konserverad C-terminal domän på ~100 aminosyror. N-terminala domäner grupperas i klasser AC beroende på deras cysteinmönster. C-term-domäner grupperas genom sekvenshomologi i klasserna I-III, med uppenbarligen ingen begränsning på vilka N-term-klasser de kan para sig med för att bilda en fullständig VSG. För att dimerisera bildar VSG N-terminala domäner en bunt av fyra alfa-helixar som styrs av hydrofoba interaktioner, runt vilka hänger mindre strukturella egenskaper (fem mindre helixar och tre beta-ark).
VSG är förankrat till cellmembranet via ett glykofosfatidylinositol (GPI) ankare - en icke-kovalent koppling från C-terminalen som styr dess framåtriktade trafik från ER till membranet. Detta GPI-ankare klyvs specifikt av GPI-fosfolipas C, klyver membranformen VSG och tillåter att VSG-protein och en del av GPI-ankaret går förlorad i den extracellulära miljön som lösligt VSG (sVSG, vilket kan kännas igen som korsreagerande Determinant, eller CRD), samtidigt som de två 1,2-dimyristolglycerolkedjorna behålls i membranet.
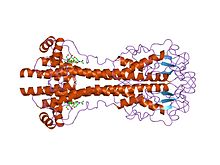
Antigen variation
VSG är mycket immunogent , och ett immunsvar mot en specifik VSG-päls kommer snabbt att döda trypanosomer som uttrycker denna variant. Antikroppsmedierad trypanosomdödning kan också observeras in vitro genom en komplementmedierad lysanalys . Men med varje celldelning finns det en möjlighet att en eller båda av avkomman kommer att byta uttryck för att ändra VSG som uttrycks. Frekvensen av VSG-omkoppling har uppmätts till ungefär 0,1 % per division, även om byteshastigheter skiljer sig i odling jämfört med in vivo . Eftersom T. brucei -populationer kan nå en topp med en storlek på 10 11 inom en värd säkerställer denna snabba byteshastighet att parasitpopulationen ständigt varierar. Ett mångsidigt utbud av päls som uttrycks av trypanosompopulationen gör att immunsystemet alltid ligger ett steg efter: det tar flera dagar för ett immunsvar mot en given VSG att utvecklas, vilket ger populationen tid att diversifiera sig när individer genomgår ytterligare byteshändelser. Upprepning av denna process förhindrar utrotning av den infekterande trypanosompopulationen, vilket tillåter kronisk persistens av parasiter i värden, vilket ökar möjligheterna för överföring. Den kliniska effekten av denna cykel är successiva "vågor" av parasitemi (trypanosomer i blodet).
I andra trypanosomer
Variabla ytglykoproteiner finns också i andra Trypanosoma -arter,
Hos Trypanosoma equiperdum , en parasit som orsakar täcksjuka hos hästar, tillåter dessa proteiner att parasiten effektivt undviker värddjurets immunsystem. Dessa VSG: er tillåter organismen att ständigt manipulera och ändra ytstrukturen på dess proteiner, vilket innebär att den ständigt presenteras för immunsystemet som en ny främmande organism och detta hindrar kroppen från att montera ett tillräckligt stort immunsvar för att utrota sjukdomen. I denna mening Trypanosoma equiperdum en mycket effektiv organism; den kan infektera färre arter än andra sjukdomar, men den infekterar och överlever mycket effektivt inom sina specificerade värdar. VSG-proteinerna i T. equiperdum är också fosforylerade .
En VSG-gen från Trypanosoma evansi , en parasit som orsakar en form av surra hos djur, har klonats i Escherichia coli . Det uttryckta proteinet är immunreaktivt med alla serakombinationer. Djuren immuniserade med helcellslysat eller rekombinant protein uppvisar liknande antikroppsreaktioner i ELISA (Enzyme-linked immunosorbent assay) och CATT ( kortagglutinationstest för trypanosomiasis ). Det variabla ytglykoproteinet RoTat 1.2 PCR kan användas som ett specifikt diagnostiskt verktyg för detektion av T. evansi -infektioner.
Det minsta VSG-proteinet (40 kDa i storlek) hittills (1996) har hittats i Trypanosoma vivax , som bär lite kolhydrater.
I Trypanosoma congolense visade in vitro- analyser av de inkorporerade sockerarterna efter hydrolys av glykoproteinet att glukosamin och mannos används i biosyntesen av kolhydratdelen direkt medan galaktos möjligen omvandlades till andra intermediärer innan de inkorporerades i antigenet . Den oglykosylerade VSG med en molekylvikt av 47 kDa hade fullständigt förlorat sin storleksheterogenitet.
Se även
- Pälsprotein (disambiguation)
- Glycocalyx
- Lista över MeSH-koder (D23)
- Lista över MeSH-koder (D12.776.395)
- Lista över MeSH-koder (D12.776.543)
- Amastin, ett annat ytglykoprotein (transmembran) i trypanosomatida parasiter
externa länkar
- Variant Surface Glycoproteins, Trypanosoma vid US National Library of Medicine Medical Subject Headings (MeSH)
- www.icp.ucl.ac.be

