TIM fat
| TIM-pipa av aldolastyp | |
|---|---|
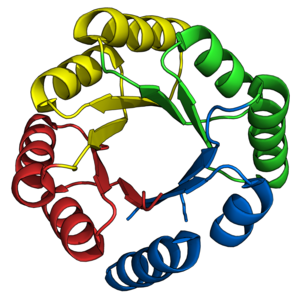
 Ovanifrån av ett triosefosfateisomeras (TIM) fat (), färgad från blå ( N-terminal ) till röd (C-terminal).
| |
| Identifierare | |
| Symbol | Aldolase_TIM |
| Pfam klan | CL0036 |
| InterPro | IPR013785 |
| CATH | 8 tim |
| SCOP2 | 8tim / SCOPe / SUPFAM |
TIM -cylindern (trios-fosfatisomeras), även känd som en alfa/beta-cylinder , är en konserverad proteinveck som består av åtta alfa-helixar (α-helixar) och åtta parallella betasträngar (β-strängar) som alternerar längs peptidryggraden . Strukturen är uppkallad efter trios-fosfatisomeras , ett konserverat metaboliskt enzym . TIM-fat är allestädes närvarande, med ungefär 10 % av alla enzymer som använder denna veck. Vidare inkluderar fem av sju enzymkommission (EC) enzymklasser TIM-fatproteiner. TIM-fatvecket är evolutionärt gammalt , med många av dess medlemmar som har liten likhet idag, istället faller de inom skymningszonen av sekvenslikhet .
Den inre betapipan (β-pipan) stabiliseras i många fall av invecklade saltbryggnätverk . Slingor vid de C-terminala ändarna av β-pipan är ansvariga för katalytisk aktivitet medan N-terminala ändslingor är viktiga för stabiliteten hos TIM-piporna. Strukturella insättningar som sträcker sig från förlängda loopar till oberoende proteindomäner kan infogas i stället för dessa loopar eller vid N-terminalen/C-terminalerna. TIM-fat verkar ha utvecklats genom genduplicering och domänfusionshändelser av halvfatsproteiner, med en majoritet av TIM-fat som kommer från en gemensam förfader . Detta ledde till att många TIM-fat hade interna symmetrier. Ytterligare gendupliceringshändelser av detta förfäders TIM-fat ledde till divergerande enzymer som hade den funktionella mångfald som observeras idag. TIM - fat har också varit ett långvarigt mål för proteindesigners . Framgångsrika TIM-fatdesigner inkluderar både domänfusioner av befintliga proteiner och de novo- designer. Domänfusionsexperiment har resulterat i många framgångsrika designs, medan de novo- designer endast gav framgångar efter 28 år av stegvis utveckling.
Strukturera


Topologi
TIM-fatet har fått sitt namn från enzymet trios-fosfatisomeras (TIM), som var det första proteinet som hade vecket som kristalliserades . TIM-fat innehåller 200-250 aminosyrarester, vikta i 8 alfa-helixar (α-helixar) och 8 beta-strängar (β-strängar). β-strängarna är arrangerade i en parallell beta-cylinder (β-pipa), och omges av de 8 α-helixarna. Den definierande egenskapen hos TIM β-pipor är att de alltid har ett skjuvtal på 8. Skjuvtalet bestäms genom att plocka en rest x på β-sträng-1, och röra sig längs β-pipan, i en vinkelrät riktning mot riktningen för strängarna, tills rest y på den ursprungliga β-strängen-1 nås. Antalet rester mellan start- och slutpositionen (|y−x|) är skjuvtalet. Eftersom antalet strängar är lika med skjuvtalet pekar sidokedjorna omväxlande mot poren och kärnan, vilket ger en 4-faldig symmetri. α-helixarna omger och omsluter helt den inre β-pipan. Korta slingor förbinder vanligtvis α- och β-sekundära strukturer och bildar en (βα) 8 -upprepningstopologi. I vissa fall kan strukturer som sträcker sig från utökade slingor till oberoende domäner infogas i stället för dessa slingor, eller kan fästas till N/C-terminalerna. Alla TIM-cylinderenzym har katalytiska ställen vid den C-terminala änden av β-cylindern, och strukturella inlägg som finns nära denna ände kan hjälpa till med katalytisk aktivitet.
Kärn- och porregioner
TIM-fat innehåller två distinkta begravda regioner, där aminosyrarester är helt omslutna av sina grannar och saknar tillgång till lösningsmedel. Termen "por" är en felaktig benämning, eftersom det inte finns några lösningsmedelskanaler inom denna region. Kärnregionen består av alla rester som utgör α-β-gränssnittet och ligger utanför det centrala β-röret. Porregionen består av alla inre β-fatsrester, som är omgivna och inneslutna av β-fatsryggraden.
På grund av den veckade naturen hos β-strängar delas alternativa rester längs en sträng nästan jämnt mellan poren (53 %) och kärnan (47 %). För β-fat är 95 % av deras kärnrester begravda. Endast 11% av deras kärnrester är polära , har en affinitet för vatten och har förmågan att bilda vätebindningar eller saltbryggor. På liknande sätt är 84 % av p-strängens porrester begravda. Emellertid är 42 % av deras porrester polära. Dessa rester bildar invecklade saltbryggnätverk för att kompensera för deras bristande tillgänglighet till lösningsmedel.
TIM trumstabiliserande element
Saltbryggor i TIM-trumporerna tros bidra till veckets totala stabilitet. Ett exempel på ett stort saltbryggnätverk kan hittas i 2-deoxiribos-5-fosfataldolas . Detta nätverk visade sig vara bevarat över klass I aldolasfamiljen.
Den exakta orsaken till överrepresentationen av polära rester och saltbryggor i porerna är fortfarande oklart. En studie föreslår att de förbättrar vikbarheten snarare än termodynamisk stabilitet hos TIM-fat. Under vikningsprocessen skulle inre porrester på β-strängar exponeras för vatten. Delvis vikta βαβα-moduler, kallade foldons, skulle stabiliseras energiskt av polära porrester under detta steg av veckningen.
I en annan studie som involverade S. solfataricus indol-3-glycerolfosfatsyntas TIM fatprotein, visade sig en konserverad βαβαβ-modul vara en viktig vikningsmall, som styrde veckningen av andra sekundära strukturer. β-cylinderförslutning inträffade endast i slutet av vikningsprocessen. I detta fall krediterade författarna emellertid grenade alifatiska aminosyror (valin, leucin och isoleucin) för veckstabilitet.
Ett annat stabiliserande element i TIM-fat är beta-hårnålsklämman . Donatorer av H-bindning i sidokedjor vid N-ändarna av p-strängar med jämna nummer bildar ofta H-bindningar med amidväten i huvudkedjan i föregående p-strängar med udda nummer. Dessa klämmor (eller hydrofoba sidokedjebrygganaloger) är bevarade i 3 indol-3-glycerolfosfatsyntas TIM fatortologer från bakterie- och arkérikena, vilket antyder att de uppstod i sin sista gemensamma förfader och har bevarats i över en miljard år.
Strukturella insatser

De N/C-terminala och loopregionerna på TIM-fatproteiner kan vara värd för strukturella insättningar som sträcker sig från enkla sekundära strukturella motiv till kompletta domäner . Dessa domäner hjälper till med substratigenkänning och katalytisk aktivitet. Fyra olika exempel på TIM-fat som innehåller ytterligare motiv och domäner diskuteras nedan.
Bacillus subtilis Orotidin 5'-fosfatdekarboxylas () är ett TIM-fatprotein som visar 4 α-helixar i stället för βα-slingorna som vanligtvis finns vid C-terminalen av β-fat (resterna 35-42, 89-91, 126 -133 och 215-219). En av dessa helixar (R215→K219) innehåller en konserverad argininrest (R215) som krävs för att interagera med en fosfatdel på orotidin 5'-monofosfat. De andra spiralerna visade sig inte vara värdrester som är kritiska för katalytisk aktivitet och kan tjäna i strukturella roller.
Mycobacterium tuberculosis bifunktionell histidin/tryptofanbiosyntesisomeras (PriA) () har förmågan att katalysera två reaktioner: (i) HisA-reaktion: omvandlingen av N-[(5-fosforibosyl)formimino]-5-aminoimidazol-4-karboxamidribonukleotid (ProFAR) till N-[(5-fosforibulosyl)formimino]-5-aminoimidazol-4-karboxamidribonukleotid (PRFAR), och (ii) TrpF-reaktion: N-(5'-fosforibosyl)-antranilat (PRA) till 1- (O-karboxifenylamino)-1'-deoxiribulos-5'-fosfat (CdRP). PriA är ett TIM-cylinderenzym som rymmer båda substraten genom att använda slingor med aktiva ställen (slingor 1, 5 och 6, förlängda βα-slingor vid den C-terminala änden av β-cylindern) som ändrar konformation beroende på den närvarande reaktanten. Slinga 1 lindas över den aktiva platsen endast i närvaro av ProFAR. Loop5 sveper sig över det aktiva stället och antar en β-arkkonformation i närvaro av CdRP, eller en knutliknande konformation i närvaro av ProFAR. Loop 6 lindar över det aktiva stället för alla reaktanter.
Lactococcus lactis Dihydroorotate dehydrogenase A (DHODA) () är ett exempel på en TIM-pipa som har β-skivor och förlängda öglor över den C-terminala änden av β-pipan. DHODA katalyserar oxidationen av dihydroorotat till orotat, som är en del av syntesvägen för de novo uridin 5'-monofosfat (UMP). Denna oxidation förmedlas av flavinmononukleotid (FMN). Här omsluter β-ark och förlängda slingor den aktiva platsen och bildar en hålighet, samtidigt som den är värd för flera katalytiska rester.
Methylophilus methylotrophus trimethylamine dehydrogenase () TIM-fat är ett exempel på en komplett domäninsättning. Här infogas en Rossmann-vikningsdomän vid den C-terminala änden av TIM-röret. Trimetylamindehydrogenas katalyserar omvandlingen av trimetylamin till formaldehyd. Denna reaktion kräver både en reducerad 6-S-cysteinylflavinmononukleotid (FMN) kofaktor och ett reducerat järn-svavel ([4Fe-4S] + ) centrum. FMN är kovalent bundet inom den C-terminala regionen av β-trumman. [4Fe-4S] + -centret är för stort för att rymmas i TIM-pipan och placeras istället i närheten, 7 Å bort, vid gränssnittet mellan TIM-pipan och Rossmann-vikdomänerna.
Vikmekanismer
Bevarandet av TIM-fatvecket speglas av bevarandet av dess jämvikts- och kinetiska vikningsmekanismer i bakteriella paraloger med fylogenetiskt distinkta linjer. Kemisk denaturering av flera naturliga och 2 designade TIM-fatvarianter involverar undantagslöst en högbefolkad jämviktsintermediär. De kinetiska mellanprodukterna som uppstår efter utspädning från mycket denaturerande lösningar involverar en tidig felveckad art som åtminstone delvis måste vecklas ut för att komma åt den produktiva vikningsvägen. Det hastighetsbegränsande steget vid vikning är förslutningen av den 8-strängade β-cylindern, med den föregående, öppna cylinderformen som motsvarar jämviktsintermediären. Native-centric molekylär dynamik simuleringar rekapitulera de experimentella resultaten och visar vägen till testbara beräkningsmodeller för komplexa vikningsmekanismer.
Bevarade träningslandskap
TIM-fatproteiner har en ovanligt hög sekvensplasticitet och bildar stora familjer av ortologa och paraloga enzymer i vitt divergerande organismer. Denna plasticitet antyder ett sekvenslandskap som möjliggör proteinanpassning till en mängd olika miljöförhållanden, till stor del oberoende av fylogenetisk historia, samtidigt som funktionen bibehålls. En djup mutationsskanning och en konkurrensanalys användes för att bestämma lämpligheten av alla möjliga aminosyramutanter över positioner i 3 hypertermofila indol-3-glycerolfosfatsyntas (IGPS) TIM-fat-enzymer för att stödja tillväxten av en jästvärd som saknar IGPS. Även om de 2 bakteriella och 1 arkeala IGPS-enzymerna endast var 30-40% identiska i sekvens, var deras träningslandskap starkt korrelerade: samma aminosyror på samma positioner i de tre olika proteinerna hade mycket liknande kondition. Korrelationen kan ses som bevarandet av fitnesslandskapet för ett TIM-fatenzym över evolutionär tid.
Loop regioner
Av de cirka 200 rester som krävs för att helt bilda ett TIM-fat anses cirka 160 vara strukturellt ekvivalenta mellan olika proteiner som delar denna veckning. De återstående resterna är belägna på slingområdena som länkar samman spiralerna och strängarna; slingorna vid den C-terminala änden av strängarna tenderar att innehålla det aktiva stället , vilket är en anledning till att denna veckning är så vanlig: resterna som krävs för att bibehålla strukturen och resterna som påverkar enzymatisk katalys är till största delen distinkta undergrupper: Länkslingorna kan faktiskt vara så långa att de innehåller andra proteindomäner. Nyligen har det visat sig att katalytiska slingor kan utbytas mellan olika TIM-fat-enzymer som semiautonoma enheter av funktionella grupper.
Evolution och ursprung


Den dominerande teorin för evolution av TIM-fat involverar genduplicering och fusion, som börjar med en halvfat som så småningom bildade en hel TIM-fat. Flera studier stödjer teorin om divergerande evolution från en enda förfader, och diskuteras nedan.
Evolution från en gemensam förfader
I början av 1990-talet noterades det att alla TIM-fatstrukturer som löstes vid den tiden var enzymer, vilket tyder på avvikelse från en gemensam förfader. Vidare hade alla TIM-fat aktiva platser vid den C-terminala änden av β-fat. föreslog att ett vanligt fosfatbindningsställe, bildat av en liten α-helix och TIM-cylinderloops-7/8, starkt indikerade divergerande evolution. Ytterligare studier av dessa fosfatgrupper, som drog slutsatsen att 12 av 23 SCOP TIM fatfamiljer avvek från en gemensam förfader. På samma sätt fanns det tips om gemensamma anor för 17 av de 21 CATH TIM-familjerna. Baserat på dessa rapporter anses det troligt att majoriteten av TIM-fatproteiner har utvecklats från en gemensam förfader.
Ursprung genom genduplicering och domänfusion

Många TIM-fatproteiner har 2-faldig, 4-faldig eller 8-faldig intern symmetri, vilket tyder på att TIM-fat utvecklats från förfäders (βα) 4 , (βα) 2 eller βα-motiv genom genduplicering och domänfusion . Ett bra exempel på 2-faldig intern symmetri observeras i enzymerna ProFAR-isomeras (HisA) och imidazolglycerolfosfatsyntas (HisF) i Thermotoga maritima histidinbiosyntesvägen . De katalyserar 2 på varandra följande reaktioner i vägen, har 25% sekvenshomologi och har rot-medelkvadratavvikelser (RMSDs) mellan 1,5-2 Å, vilket tyder på divergens från en gemensam förfader. Mer intressant är att slingorna på C-terminaländarna av både HisA och HisF visade ett dubbelt upprepat mönster, vilket tyder på att deras gemensamma förfader också hade 2-faldig intern symmetri. Med hjälp av dessa observationer konstruerades en modell för utvecklingen av TIM-tunnorna. En förfäders halvfat skulle ha genomgått en genduplicering och fusionshändelse, vilket resulterade i ett enda protein innehållande två halvfatsdomäner. Strukturella anpassningar skulle ha inträffat, vilket resulterade i att dessa domäner slogs samman för att bilda en sluten β-pipa och bilda en uråldrig TIM-fat. Funktionella anpassningar skulle också ha inträffat, vilket resulterade i utvecklingen av ny katalytisk aktivitet vid den C-terminala änden av β-pipan. Vid denna tidpunkt skulle den gemensamma förfadern till HisA och HisF ha genomgått en andra gendupliceringshändelse. Divergerande utveckling av de duplicerade generna från den förfäders TIM-fat skulle ha resulterat i bildandet av HisA och HisF.
Intressant nog har denna evolutionära modell validerats experimentellt med hjälp av rationell proteindesign och riktad evolution . Höcker et al. fusionerade först två C-terminala halvor av HisF, vilket gav HisF-CC. Denna konstruktion stabiliserades sedan genom införandet av en inre saltbrygga , vilket gav HisF-C*C. Ytterligare stegvis stabilisering och solubilisering av HisF-C*C uppnåddes genom att optimera halvtrumsgränssnittet, generering av HisF-C**C respektive HisF-C***C. Kristallstrukturen av HisF-C***C avslöjade ett 2-faldigt symmetriskt TIM-rör, vilket validerade möjligheten till naturlig domänfusion. Dessutom skapade Höcker de första chimära HisAF och HisFA TIM faten med HisA och HisF halvfat. Dessa experiment ledde till förslaget om ett nytt sätt för diversifiering och utveckling av TIM-fat-enzymer genom utbyte av (βα)4 halvfatsdomäner bland redan existerande TIM-fat. I enlighet med denna idé etablerades en hög katalytisk aktivitet på HisAF-konstruktionen. På liknande sätt har chimära βα 5 -flavodoxin-liknande veck (CheY)/HisF TIM-fat och ett perfekt 2-faldigt symmetriskt HisF-baserat TIM-fat också skapats.
Förekomsten av 4/8-faldig intern symmetri föreslogs baserat på en beräkningsanalys av TIM-fatsekvenser. Till exempel föreslogs Escherichia coli KDPG aldolas () ha en distinkt 4-faldig symmetri, med urskiljbar 8-faldig symmetri. Designen av en 4-faldig symmetrisk TIM-pipa bekräftade möjligheten till högre order av intern symmetri i naturliga TIM-fat, och kommer att diskuteras i detalj i nästa avsnitt. Inga experimentella bevis för förekomsten av 8-faldiga symmetriska TIM-fat har hittills rapporterats.
De novo TIM fatdesign
TIM-fatveckningen har varit ett långvarigt mål för de novo proteindesigners . Som tidigare beskrivits har många TIM-fat framgångsrikt designats baserat på redan existerande naturliga halvfat. Däremot skedde de novo- designen av TIM-fat i stegvisa steg under en period av 28 år.
Octarellin-serien av proteiner (Octarellin I→VI) var de första försöken att skapa en de novo TIM-fat. Eftersom området för proteindesign fortfarande var i sin linda, möttes dessa designförsök endast med begränsad framgång. Även om de uppvisade cirkulära dikroismspektra i överensstämmelse med αβ-proteiner och vissa samverkande veckningsegenskaper, var alla Octarellin-seriens peptider olösliga och måste återsolubiliseras från inklusionskroppar för ytterligare karakterisering. Intressant nog visade Octarellin V.1 ett Rossmann -liknande veck under samkristallförhållanden.
Symmetrinserien av proteiner (Symmetrin-1→4) uppvisade mer gynnsamma biofysiska egenskaper. Symmetrin-1 var lättlösligt, uppvisade cirkulära dikroismspektra i överensstämmelse med αβ-proteiner och uppvisade utmärkta samarbets- och återveckningsegenskaper. Trots dessa framsteg visade alla proteiner i denna familj smälta egenskaper när de analyserades med NMR ( kärnmagnetisk resonans ), och ytterligare arbete för att lösa deras strukturer kunde inte genomföras.
Proteiner i sTIM-serien representerade den första framgångsrika de novo TIM-fatdesignen. sTIM-11 () designades med en intern 4-faldig symmetri för att minska komplexiteten i beräkningsdesign med hjälp av Rosetta-programsviten. Tidigare härledda första principer användes för att avgränsa sekundära strukturtopologier och längder. sTIM-11 visade sig vara en mycket termostabil , kooperativt hopfällbar design som antog sin avsedda struktur.
Se även
externa länkar
- SCOP-lista över proteiner som använder TIM-fatvecket
- Babu MM (1998). "TIM fatanalys" . Centrum för bioteknik, Anna universitet .