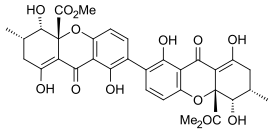
Sekalonsyra
Sekalonsyror är en grupp av kirala dimera tetrahydroxantoner som är nära besläktade med ergoflavin och ergochrysin A som gemensamt kallas ergokromer och tillhör en klass av mykotoxiner som initialt isolerats som stora ergotpigment från svampen Claviceps purpurea som växer parasitiskt på rågräs . Från tidiga tider och särskilt i det medeltida Europa har konsumtionen av spannmål som innehåller mjöldryn upprepade gånger lett till massförgiftningar som kallas ergotism som orsakades av giftiga mjöldryga alkaloider och mykotoxiner såsom ergokromer, på grund av förorening av mjöl av C. purpurea . Ett kluster av gener som är ansvariga för syntesen av sekalonsyror i C. purpurea har identifierats. Sekalonsyra D, enantiomeren av sekalonsyra A, är ett stort miljötoxin, isolerat från svampen Penicillium oxalicum , och är en viktig mikrobiell förorening av nyskördad majs som orsakar toxicitet genom kontaminering av livsmedel.
- Major Ergot Ergochromes och Secalonic acid D
Förekomst
Utöver förekomsten i C. purpurea har även sekalonsyrorna A, B, D och ergoflavin isolerats från andra svampar, och de tre sekalonsyrorna har även hittats i olika lavar. Hittills har minst tjugotvå medlemmar av ergokromfamiljen isolerats och strukturellt identifierats, inklusive sekalonsyra E (enantiomeren av sekalonsyra A) från svampen Phoma terrestris, sekalonsyra F från svampen Aspergillus aculeatus och sekalonsyra G från svampen Pyrenochaeta terrestris . Dessutom har de monomera enheterna av de dimera sekalonsyrorna, nämligen hemisekalonsyrorna B och E (blennolider A och E) isolerats från Blennoria sp ., en endofytisk svamp från Carpobrotus edulis .
Bioaktivitet
Sekalonfamiljen av sekundära metabolitmykotoxiner uppvisar intressanta bioaktiviteter. Sekalonsyra A har antitumöregenskaper och minskar också kolkicintoxiciteten i kortikala nervceller från råtta . Dessutom har det visats att sekalonsyra A skyddar mot dopaminerg neurondöd i en musmodell med Parkinsons sjukdom . Sekalonsyra B har också antitumöraktivitet. När det testades mot B16 murint melanom visade sig det vara aktivt i det låga mikromolära området. Det visade sig också vara ett effektivt antimikrobiellt medel mot de grampositiva bakterierna ( Bacillus megaterium ) och de gramnegativa bakterierna ( Escherichia coli ) och visade sig vara svampdödande mot ( Microbotryum violaceum ) och antialg mot ( Chlorella fusca ). Sekalonsyra D (SAD) är en giftig och teratogen metabolit. Fosterskada effekter observerades i utvecklingen av råttor som exponerades för SAD injicerade under fosterutvecklingen. SAD uppvisade potent cytotoxicitet på multidrug resistens (MDR) celler och deras föräldraceller. Undersökning av antitumöraktiviteten hos SAD visade att den utövade potent cytotoxisk aktivitet på SP-celler, på grund av induktion av ABCG2- nedbrytning genom aktivering av calpain-1 . Ergoflavin visade god antiinflammatorisk aktivitet och goda anticanceraktiviteter inklusive signifikant hämning av proliferation, särskilt i pankreas-, njur- och lungcancerceller, och kan utöva sina effekter via mekanismer som liknar sekalonsyra D.
Strukturera
Ergoflavin isolerades först i ren form från Claviceps purpurea (ergot) 1958. Det visades vara en 2,2'-biarylkopplad dimer 1963 och strukturen bekräftades det året genom enkristallröntgenanalys. Under det följande decenniet var strukturerna för sekalonsyrorna A, B, C, D och ergochrysin A på liknande sätt fast etablerade, och även om det fanns en viss tidig diskussion om de var 2,2'-, 4,4'- eller till och med 2,4 '-kopplad bekräftades det att även de alla var 2,2'-kopplade mellan bifenylresterna. I alla kända sekalonsyror visar sig metyl- och metoxikarbonylsubstituenterna vara trans till varandra, och röntgenanalys av kristallstrukturen för sekalonsyra A visade att 2,2'-biarylbindningen var icke-plan och vinkeln mellan två bifenylplan var 36,5°.
De tetrahydroxantoninnehållande sekalonsyrorna har visat sig vara instabila under basiska betingelser, och de kan lätt genomgå isomeriseringar som härrör från eterbindningsersättning. Den 2-2'-kopplade sekalonsyran A isomeriseras i DMSO vid rumstemperatur till 2-4'-kopplad sekalonsyra A och 4-4'-kopplad sekalonsyra A under 13 timmar, för att nå en jämvikt på 3,2 : 2 : 1. Denna isomerisering går snabbare i närvaro av bas (DMSO/pyridin).
Syntes
Det gemensamma nyckeldraget i syntesen av ergoflavin och sekalonsyrorna är biaryldimeriseringen av skyddade jod-arylmonomerer med Cu eller Pd. Whalleys syntes av ergoflavin 3 från hemiergoflavin 1 1971 uppnåddes genom en lågutbyteskoppling av två skyddade 2-jod-hemiegoflavinmonomerer 2 med koppar under Ullmann -reaktionsbetingelserna, följt av syraavskyddande.
På liknande sätt mer än fyrtio år senare involverade Porcos syntes av den mer labila sekalonsyran D i 60 % utbyte koppling av två skyddade jodmonomerer via deras stannes med CuCl vid rumstemperatur, medan Tietze uppnådde en liknande syntes av sekalonsyra E genom att koppla två skyddade jodmonomerer med Pd (OAc) 2 under Suzuki-betingelser vid 70 °C i 85 % utbyte.