Ketonhalogenering
Inom organisk kemi är α-keto halogenering en speciell typ av halogenering . Reaktionen kan utföras under antingen sura eller basiska betingelser i ett vattenhaltigt medium med motsvarande elementära halogen. På detta sätt kan klorid-, bromid- och jodidfunktionalitet (men framför allt inte fluorid) infogas selektivt i alfapositionen av en keton.
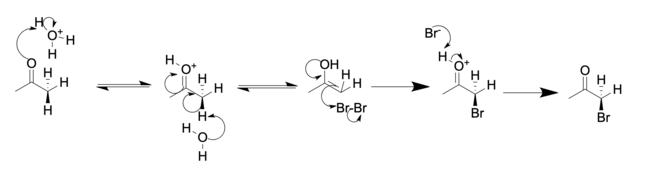
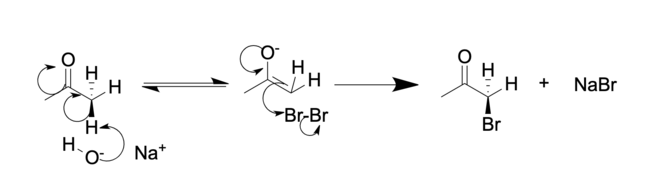
Positionen alfa till karbonylgruppen i en keton är lätt halogenerad. Detta beror på dess förmåga att bilda ett enolat i basisk lösning, eller en enol i sur lösning. Ett exempel på alfahalogenering är monobromeringen av aceton , utförd under antingen sura eller basiska förhållanden, för att ge bromaceton :
Surt (i ättiksyra):
Basisk (i vattenhaltig NaOH):
I sur lösning ersätts vanligtvis bara ett alfaväte med en halogen, eftersom varje successiv halogenering är långsammare än den första. Halogenen minskar basiciteten hos karbonylsyren, vilket gör protoneringen mindre gynnsam. I grundläggande lösningar är emellertid successiv halogenering snabbare på grund av induktivt elektronbortdragande av halogenen. Detta gör de återstående vätena surare. När det gäller metylketoner sker denna reaktion ofta en tredje gång för att bilda en ketontrihalid, som kan genomgå snabb substitution med vatten för att bilda ett karboxylat i vad som kallas haloformreaktionen .
Regioselektiviteten skiljer sig också: Halogeneringen av en osymmetrisk keton i syra resulterar i att den mer substituerade alkylgruppen halogeneras . En andra ekvivalent av halogen resulterar i halogenering av den andra alkylsubstituenten (utan halogenen). I motsats härtill, i basiska lösningar, halogeneras en osymmetrisk keton vid den mindre substituerade alkylgruppen. Efterföljande halogenering (som vanligtvis inte kan stoppas genom styrning av stökiometri) sker i den position som redan har en halogensubstituent, tills alla väten har ersatts av halogenatomer. För metylalkylketoner (2-alkanoner) fortsätter haloformreaktionen för att ge karboxylsyran selektivt.
Halogenering av α,β-omättade ketoner
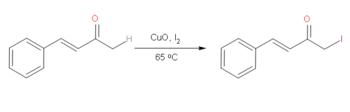
På α,β-omättade ketoner eller enoner är det möjligt att halogenera med jod selektivt på den mer mättade alfa på ketonen selektivt över den omättade sidan. Jod föredras eftersom det är mer reaktivt än alkylbromider, vilket gör denna reaktion ganska användbar. Genom att använda CuO i kombination med I2 är det möjligt att uppnå denna reaktion under relativt milda förhållanden. Denna reaktion genomgår en mycket reaktiv enolmekanism , som underlättas av CuO, som möjliggör selektiv tillsats av I2 på det mättade alfakolet i ketonen. Effektiviteten av denna reaktion beror emellertid på närvaron av funktionella arylgrupper.
Tillämpningar inom grön kemi
Alfa-halogenerade produkter är mycket användbara föreningar eftersom de har hög reaktivitet vilket gör dem mycket benägna att reagera. Alfa-halogenerade ketoner reagerar med nukleofiler för att skapa många värdefulla föreningar. Många av de nuvarande metoderna för ketonhalogenering använder dock farliga kemikalier, har komplexa procedurer och/eller kräver lång tid för att slutföras. Dessutom är de polära lösningsmedel som främst används (DMF, DMSO och CH 3 CN) stora miljöföroreningar.
Ett experiment utfört av Meshram et al. 2005 undersökte man att göra ketonhalogenering till en grönare reaktion, enligt principerna för grön kemi . Meshram et al. undersökte alternativ till de farliga kemikalier som främst används i ketonhalogenering, och fann att rumstempererade joniska vätskor var ett lovande alternativ. Rumstempererade joniska vätskor är intressanta möjligheter eftersom de har unika kemiska och fysikaliska egenskaper, och deras egenskaper kan modifieras genom att ändra katjonerna som är fästa. Dessutom har dessa joniska vätskor hög polaritet och deras förmåga att solubilisera organiska och oorganiska molekyler leder till ökade reaktionshastigheter, vilket gör dem mer önskvärda.
Många experiment fann att joniska vätskor med N-halosuccinimider som lösningsmedel var ett effektivt, grönare alternativ till konventionella lösningsmedel. Denna process resulterade också i ökat utbyte, minskad reaktionstid, förenklade proceduren, använde mindre skadliga kemikalier (inga starka syror) och krävde inga katalysatorer , vilket allt gjorde processen grönare.