Platsspecifik rekombinasteknologi
Platsspecifika rekombinasteknologier är genomteknikverktyg som är beroende av rekombinasenzymer för att ersätta riktade sektioner av DNA.
Historia
I slutet av 1980-talet möjliggjorde geninriktning i murina embryonala stamceller (ESC) överföring av mutationer in i musens könslinje, och dök upp som ett nytt alternativ för att studera den genetiska grunden för regulatoriska nätverk som de existerar i genomet. Ändå visade sig klassisk geninriktning vara begränsad på flera sätt eftersom genfunktioner blev irreversibelt förstörda av markörgenen som var tvungen att introduceras för att välja rekombinanta ESC. Dessa tidiga steg ledde till att djur där mutationen var närvarande i alla kroppens celler från början ledde till komplexa fenotyper och/eller tidig dödlighet. Det fanns ett tydligt behov av metoder för att begränsa dessa mutationer till specifika punkter i utvecklingen och specifika celltyper. Denna dröm blev verklighet när grupper i USA kunde introducera bakteriofag och jäst-derived site-specific recombination (SSR-) system i däggdjursceller såväl som i musen.
Klassificering, egenskaper och dedikerade applikationer
Vanliga genteknikstrategier kräver en permanent modifiering av målgenomet. För detta ändamål måste stor sofistikering investeras i utformningen av vägar som används för leverans av transgener. Även om slumpmässig integration fortfarande är vanligt för biotekniska ändamål, kan det resultera i oförutsägbart genuttryck på grund av variabla transgenkopietal, brist på kontroll över integrationsställen och associerade mutationer. De molekylära kraven inom stamcellsområdet är mycket strängare. Här homolog rekombination (HR) i princip ge specificitet till integrationsprocessen, men för eukaryoter äventyras den av en extremt låg effektivitet. Även om meganukleaser, zinkfinger- och transkriptionsaktivatorliknande effektornukleaser (ZFN och TALEN) är verkliga verktyg som stödjer HR, var det tillgängligheten av platsspecifika rekombinaser (SSR) som utlöste den rationella konstruktionen av cellinjer med förutsägbara egenskaper. Nuförtiden kan båda teknologierna, HR och SSR kombineras i högeffektiva "tag-and-exchange-teknologier".
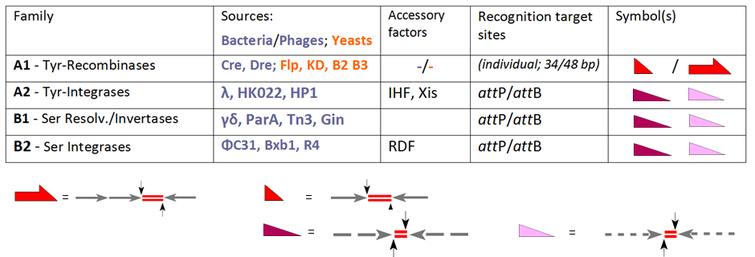
Många platsspecifika rekombinationssystem har identifierats för att utföra dessa DNA-omarrangemang för en mängd olika ändamål, men nästan alla av dessa tillhör någon av två familjer, tyrosinrekombinaser (YR) och serinrekombinaser (SR), beroende på deras mekanism . Dessa två familjer kan förmedla upp till tre typer av DNA-omarrangemang (integration, excision/upplösning och inversion) längs olika reaktionsvägar baserat på deras ursprung och arkitektur.
Den grundande medlemmen av YR-familjen är lambda-integraset, kodat av bakteriofag λ , vilket möjliggör integration av fag-DNA i bakteriegenomet. Ett gemensamt kännetecken för denna klass är en konserverad tyrosinnukleofil som angriper det sprickbara DNA-fosfatet för att bilda en 3'-fosfotyrosinbindning. Tidiga medlemmar av SR-familjen är närbesläktade resolvas /DNA-invertaser från de bakteriella transposonerna Tn3 och γδ, som förlitar sig på ett katalytiskt serin som är ansvarigt för att attackera det klyvliga fosfatet för att bilda en 5'-fosfoserinkoppling. Dessa obestridda fakta äventyrades dock av en hel del förvirring när andra medlemmar kom in på scenen, till exempel YR-rekombinaserna Cre och Flp (kapabla till integration, excision/upplösning såväl som inversion), som ändå välkomnades som nya medlemmar i "integrase-familjen". De omvända exemplen är PhiC31 och relaterade SR, som ursprungligen introducerades som resolvaser/invertaser, även om integration är deras enda funktion, i frånvaro av hjälpfaktorer. Nuförtiden bestämmer standardaktiviteten för varje enzym dess klassificering och reserverar den allmänna termen "rekombinas" för familjemedlemmar som i sig omfattar alla tre vägarna, INT, RES och INV:
Vår tabell utökar urvalet av de konventionella SSR-systemen och grupperar dessa efter deras prestanda. Alla dessa enzymer rekombinerar två målställen, som antingen är identiska (underfamilj A1) eller distinkta (faghärledda enzymer i A2, B1 och B2). Medan dessa ställen för A1 har individuella beteckningar (" FRT " i fallet med Flp-rekombinas, loxP för Cre-rekombinas), är termerna " att P" och " att B" (fästställen på fag- respektive bakteriedelen) gäller i övriga fall. I fallet med underfamilj A1 måste vi ta itu med korta (vanligtvis 34 bp-) platser som består av två (nästan) identiska 13 bp-armar (pilar) som flankerar en 8 bp spacer (överkorsningsregionen, indikerad med röd linje dubbletter). Observera att för Flp finns det en alternativ, 48 bp plats tillgänglig med tre armar, som var och en rymmer en Flp-enhet (en så kallad "protomer"). att P- och att B-platser följer liknande arkitektoniska regler, men här uppvisar armarna endast partiell identitet (indikerat med de streckade linjerna) och skiljer sig åt i båda fallen. Dessa funktioner står för relevanta skillnader:
- rekombination av två identiska eduktställen leder till produktställen med samma sammansättning, även om de innehåller armar från båda substraten; dessa omvandlingar är reversibla;
- vid att P x att B kan rekombinationsöverkorsningar endast ske mellan dessa komplementära partners i processer som leder till två olika produkter ( att P x att B → att R + att L) på ett irreversibelt sätt.
För att effektivisera detta kapitel kommer följande implementeringar att fokuseras på två rekombinaser (Flp och Cre) och bara en integras (PhiC31) eftersom deras spektrum täcker de verktyg som för närvarande mest används för riktade genommodifieringar. Detta kommer att göras inom ramen för följande översikt.

Reaktionsvägar
Modens integration/upplösning och inversion (INT/RES och INV) beror på orienteringen av rekombinasmålställena (RTS), bland dessa par av attP och attB . Sektion C indikerar, på ett strömlinjeformat sätt, hur rekombinasmedierad kassettutbyte (RMCE) kan nås genom synkrona dubbel-reciproka korsningar (snarare än integration, följt av upplösning).
Tyr-rekombinaser är reversibla, medan Ser-Integrase är enkelriktad. Att notera är hur reversibel Flp (ett Tyr-rekombinas) integration/upplösning moduleras med 48 bp (i stället för 34 bp minimal) FRT- versioner: den extra 13 bp armen fungerar som en Flp "landningsbana" som bidrar till bildandet av synaptiska komplex, både i samband med Flp-INT- och Flp-RMCE-funktioner (se respektive jämviktssituationer). Även om det knappt är möjligt att förhindra den (entropidrivna) återgången av integration i sektion A för Cre och svårt att uppnå för Flp, kan RMCE slutföras om donatorplasmiden tillhandahålls i ett överskott på grund av den bimolekylära karaktären hos både framåtriktat - och den omvända reaktionen. Att placera båda FRT- ställena på ett omvänt sätt kommer att leda till en jämvikt mellan båda orienteringarna för insättningen (grön pil). I motsats till Flp leder Ser-integrasen PhiC31 (bottenrepresentationer) till enkelriktad integration, åtminstone i frånvaro av en rekombinas-riktningsfaktor (RDF-). I förhållande till Flp-RMCE, som kräver två olika ("heterospecifika") FRT -spacer-mutanter, träffas reaktionspartnern ( attB ) för det första reagerande attP -stället godtyckligt, så att det inte finns någon kontroll över riktningen i donatorkassetten kommer in i målet (jfr de alternativa produkterna). Också olika från Flp-RMCE , kan flera distinkta RMCE-mål inte monteras parallellt, på grund av bristen på heterospecifika (icke-korsinteragerande) att P/ attB -kombinationer.
Cre rekombinas
Cre-rekombinas (Cre) kan rekombinera specifika sekvenser av DNA utan behov av kofaktorer . Enzymet känner igen 34 baspars DNA-sekvenser som kallas loxP ("locus of crossover i fag P1"). Beroende på orienteringen av målställena i förhållande till varandra, kommer Cre att integrera/klippa ut eller invertera DNA-sekvenser. Vid excision (kallad "upplösning" i fallet med ett cirkulärt substrat) av en viss DNA-region, är normalt genuttryck avsevärt äventyrat eller avslutat.
På grund av Cres uttalade upplösningsaktivitet var en av dess initiala tillämpningar excision av lox P-flankerade ("floxade") gener som ledde till cellspecifik gen-knockout av en sådan floxad gen efter att Cre uttryckts i vävnaden av intresse. Nuvarande teknologier innehåller metoder som möjliggör både rumslig och tidsmässig kontroll av Cre-aktivitet. En vanlig metod som underlättar den rumsliga kontrollen av genetisk förändring involverar valet av en vävnadsspecifik promotor för att driva Cre-uttryck. Placering av Cre under kontroll av en sådan promotor resulterar i lokaliserad, vävnadsspecifik expression. Som ett exempel, Leone et al. har placerat transkriptionsenheten under kontroll av de regulatoriska sekvenserna av myelinproteolipidprotein (PLP)-genen, vilket leder till inducerat avlägsnande av riktade gensekvenser i oligodendrocyter och Schwann-celler . Det specifika DNA-fragment som känns igen av Cre förblir intakt i celler som inte uttrycker PLP-genen; detta i sin tur underlättar empirisk observation av de lokaliserade effekterna av genomförändringar i myelinskidan som omger nervfibrer i det centrala nervsystemet (CNS) och det perifera nervsystemet (PNS). Selektivt Cre-uttryck har också uppnåtts i många andra celltyper och vävnader.
För att kontrollera den temporala aktiviteten av excisionsreaktionen har former av Cre som drar fördel av olika ligandbindande domäner utvecklats. En framgångsrik strategi för att inducera specifik temporal Cre-aktivitet involverar fusion av enzymet med en muterad ligandbindande domän för den humana östrogenreceptorn (ERt). Efter introduktionen av tamoxifen (en östrogenreceptorantagonist ) kan Cre-ERt-konstruktionen penetrera kärnan och inducera riktad mutation. ERt binder tamoxifen med större affinitet än endogena östrogener , vilket gör att Cre-ERt förblir cytoplasmiskt hos djur som inte behandlats med tamoxifen. Den tidsmässiga kontrollen av SSR-aktivitet av tamoxifen tillåter att genetiska förändringar induceras senare i embryogenes och/eller i vuxna vävnader. Detta gör det möjligt för forskare att kringgå embryonal dödlighet samtidigt som de undersöker funktionen hos riktade gener.
Nya utvidgningar av dessa allmänna koncept ledde till generering av "Cre-zoo", dvs samlingar av hundratals musstammar för vilka definierade gener kan raderas genom riktat Cre-uttryck.

Flp-rekombinas
I sin naturliga värd (S. cerevisiae) möjliggör Flp/ FRT -systemet replikering av en "2μ-plasmid" genom inversion av ett segment som flankeras av två identiska, men motsatt orienterade FRT- ställen ("flippas"-aktivitet). Denna inversion ändrar den relativa orienteringen av replikationsgafflarna i plasmiden, vilket möjliggör "rullande cirkel" - förstärkning av den cirkulära 2μ-enheten innan de multimera mellanprodukterna löses för att frigöra flera monomera produkter. Medan 34 bp minimala FRT- ställen gynnar excision/upplösning i liknande utsträckning som de analoga lox P-ställena för Cre, möjliggör de naturliga, mer förlängda 48 bp FRT-varianterna en högre grad av integration, samtidigt som de övervinner vissa promiskuösa interaktioner som beskrivs för fagenzymer som t.ex. Cre- och PhiC31. En ytterligare fördel är det faktum att enkla regler kan tillämpas för att generera heterospecifika FRT- ställen som genomgår korsningar med lika partners men inte med vildtyps- FRT . Dessa fakta har möjliggjort, sedan 1994, utvecklingen och kontinuerliga förbättringar av rekombinasförmedlat kassettutbyte (RMCE-) som tillåter ett rent utbyte av en målkassett mot en inkommande donatorkassett.
Baserat på RMCE-teknologin har en särskild resurs av förkarakteriserade ES-stammar som lämpar sig för vidareutveckling utvecklats inom ramen för EUCOMM-programmet (European Conditional Mouse Mutagenese), baserat på det nu etablerade Cre- och/eller Flp-programmet. baserade "FlExing" (Flp-medierad excision/inversion) inställningar, som involverar excision och inversionsaktiviteter. Detta projekt inleddes 2005 och fokuserade först på mättnadsmutagenes för att möjliggöra fullständig funktionell annotering av musgenomet (koordinerat av International Knockout-Mouse Consortium, IKMC) med det slutliga målet att få alla proteingener muterade via geninfångning och -inriktning i murina ES-celler. Dessa ansträngningar markerar toppen av olika "tag-och-utbyte"-strategier, som är dedikerade till att tagga en distinkt genomisk plats så att "taggen" kan fungera som en adress för att introducera ny (eller ändra befintlig) genetisk information. Taggningssteget i sig kan adressera vissa klasser av integrationsplatser genom att utnyttja integrationspreferenser för retrovirus eller till och med platsspecifika integraser som PhiC31, som båda fungerar på ett i huvudsak enkelriktat sätt.
De traditionella, mödosamma "tag-och-utbyte"-förfarandena förlitade sig på två på varandra följande homologa rekombinationssteg (HR-), det första ("HR1") för att introducera en tagg bestående av en selektionsmarkörgen. "HR2" användes sedan för att ersätta markören med "GOI. I den första ("knock-out"-) reaktionen märktes genen med en valbar markör, typiskt genom införande av en hygtk ([+/-]) kassett ger G418-resistens I följande "knock-in"-steg ersattes den taggade genomiska sekvensen av homologa genomiska sekvenser med vissa mutationer.Cellkloner kunde sedan isoleras genom deras resistens mot ganciklovir på grund av förlust av HSV-tk-genen, dvs. ("negativt urval"). Denna konventionella tvåstegs tagg-och-utbytesprocedur skulle kunna strömlinjeformas efter tillkomsten av RMCE, vilket skulle kunna ta över och öka effektiviteten till knock-in-steget.
PhiC31 integras
Utan större tvekan är Ser- integraser de nuvarande verktygen för att integrera transgener i ett begränsat antal välförstådda genomiska acceptorställen som för det mesta (men inte alltid) efterliknar fagen att P-stället genom att de attraherar en att B-innehållande donatorvektor . Vid denna tidpunkt är den mest framstående medlemmen PhiC31-INT med bevisad potential i samband med mänskliga och musgenom.
I motsats till ovanstående Tyr-rekombinaser verkar PhiC31-INT som sådan på ett enkelriktat sätt och låser fast donatorvektorn vid ett genomiskt förankrat mål. En uppenbar fördel med detta system är att det kan förlita sig på omodifierade, infödda att P (acceptor) och att B-donatorplatser. Ytterligare fördelar (tillsammans med vissa komplikationer) kan uppstå från det faktum att mus- och mänskliga genom i sig innehåller ett begränsat antal endogena mål (så kallade " att P-pseudosites"). Tillgänglig information tyder på att avsevärda DNA-sekvenskrav låter integraset känna igen färre ställen än retrovirala eller till och med transposasbaserade integrationssystem som öppnar sin karriär som en överlägsen bärare för transport och insättning på ett antal väletablerade genomiska ställen, av vilka några med så kallas "safe-harbor"-fastigheter.
Genom att utnyttja faktumet av specifika ( att P x att B) rekombinationsvägar, blir RMCE möjligt utan krav på syntetiska, heterospecifika att -ställen. Denna uppenbara fördel kommer emellertid på bekostnad av vissa brister, såsom bristande kontroll över typen eller riktningen av den inkommande (donator-) kassetten. Ytterligare begränsningar åläggs av det faktum att irreversibilitet inte tillåter standardmultiplex -RMCE- uppsättningar inklusive "seriella RMCE"-reaktioner, dvs upprepade kassettutbyten vid ett givet genomiskt lokus .
Utsikter och perspektiv
Annotering av människans och musens genom har lett till identifieringen av >20 000 proteinkodande gener och >3 000 icke-kodande RNA-gener, som styr utvecklingen av organismen från befruktning via embryogenes till vuxenliv. Även om dramatiska framsteg noteras, har relevansen av sällsynta genvarianter förblivit ett centralt forskningsämne.
Som en av de viktigaste plattformarna för att hantera ryggradsgenfunktioner i stor skala, har genomomfattande genetiska resurser av mutanta murina ES-celler etablerats. För detta ändamål har fyra internationella program som syftar till mättnadsmutagenes av musgenomet grundats i Europa och Nordamerika (EUCOMM, KOMP, NorCOMM och TIGM). Samordnade av International Knockout Mouse Consortium (IKSC) är dessa ES-cellförråd tillgängliga för utbyte mellan internationella forskningsenheter. Nuvarande resurser omfattar mutationer i 11 539 unika gener, varav 4 414 är villkorade.
Den relevanta tekniken har nu nått en nivå som tillåter att de utvidgas till andra däggdjursarter och mänskliga stamceller, mest framträdande de med en iPS- status (inducerad pluripotent).
Se även
- Platsspecifik rekombination
- Rekombinas-medierat kassettbyte
- Cre rekombinas
- Cre-Lox rekombination
- FLP-FRT rekombination
- Genetisk rekombination
- Homolog rekombination
externa länkar
- http://www.knockoutmouse.org/
- Emes, RD; Goodstadt, L; Winter, EE; Ponting, CP (2003). "Jämförelse av genomerna hos människa och mus lägger grunden för genomzoologin. " Hum Mol Genet . 12 (7): 701–9. doi : 10.1093/hmg/ddg078 . PMID 12651866 .