Nutriepigenomik
Nutriepigenomics är studiet av matens näringsämnen och deras effekter på människors hälsa genom epigenetiska modifieringar. Det finns nu betydande bevis för att näringsobalanser under graviditet och amning är kopplade till icke-smittsamma sjukdomar , såsom fetma , hjärt-kärlsjukdomar , diabetes , högt blodtryck och cancer . Om metabola störningar inträffar under kritiska tidsfönster för utveckling, kan de resulterande epigenetiska förändringarna leda till permanenta förändringar i vävnads- och organstruktur eller funktion och predisponera individer för sjukdom.
Översikt
Epigenetik relaterar till ärftliga förändringar i genfunktion som sker oberoende av förändringar i primär DNA- sekvens. Två stora epigenetiska mekanismer som är inblandade i nutriepigenomik är DNA-metylering och histonmodifiering . DNA-metylering i genpromotorregioner resulterar vanligtvis i gentystnad och påverkar genuttryck. Även om denna form av gentystnad är extremt viktig i utveckling och celldifferentiering, kan avvikande DNA-metylering vara skadligt och har kopplats till olika sjukdomsprocesser, såsom cancer. Metylgrupperna som används vid DNA-metylering härrör ofta från kostkällor, såsom folat och kolin , och förklarar varför kosten kan ha en betydande inverkan på metyleringsmönster och genuttryck. Gentystnad kan också förstärkas genom rekrytering av histondeacetylaser för att minska transkriptionsaktiveringen. Omvänt histonacetylering transkriptionell aktivering för att öka genuttrycket. Kostkomponenter kan påverka dessa epigenetiska händelser och därigenom förändra genuttrycket och störande funktioner som aptitkontroll, metabol balans och bränsleutnyttjande.
Olika genetiska sekvenser kan riktas mot epigenetisk modifiering. En transkriptomomfattande analys på möss fann att en proteinbegränsad (PR) diet under dräktigheten resulterade i differentiellt genuttryck i cirka 1 % av de analyserade fostergenerna (235/22 690). Specifikt sågs ökat uttryck i gener involverade i p53 -vägen, apoptos , negativa regulatorer av cellmetabolism och gener relaterade till epigenetisk kontroll. Ytterligare studier har undersökt effekten av en PR-diet på råttor och funnit förändringar i promotormetylering av både glukokortikoidreceptorn och peroxisomproliferatoraktiverad receptor (PPAR). Förändrat uttryck av dessa receptorer kan resultera i förhöjda blodsockernivåer och påverka lipid- och kolhydratmetabolismen. Att utfodra en PR-diet till gravida och/eller ammande möss ökade också uttrycket av glukokinas , acetyl-CoA-karboxylas , PPARα och acyl-CoA-oxidas . Förändringar i uttryck berodde enligt uppgift på epigenetisk reglering av antingen genpromotorn själv eller promotorer av transkriptionsfaktorer som reglerar genuttryck. Ytterligare gener som har visat sig, antingen genom in vitro- eller in vivo- studier, regleras av epigenetiska mekanismer inkluderar leptin , SOCS3 , glukostransportör (GLUT)-4, POMC , 11-β-hydroxisteroiddehydrogenas typ 2 och kortikotrofinfrisättande hormon . Epigenetisk modifiering av dessa gener kan leda till "metabolisk programmering" av fostret och resultera i långsiktiga förändringar i metabolism och energihomeostas.
Nutriepigenomik och utveckling
Den utvecklingsperiod under vilken den näringsmässiga obalansen uppstår är mycket viktig för att avgöra vilka sjukdomsrelaterade gener som kommer att påverkas. Olika organ har kritiska utvecklingsstadier, och den tidpunkt då de äventyras kommer att predisponera individer för specifika sjukdomar. Epigenetiska modifieringar som inträffar under utvecklingen kanske inte uttrycks förrän senare i livet beroende på genens funktion. Medan majoriteten av studier antyder prenatala och perinatala perioder som kritiska tidsfönster, har viss forskning visat att näringsintag under vuxen ålder också kan påverka epigenomet.
Prenatal
Utvecklingsplasticitet är den process där fostret anpassar sig till sin miljö. Miljösignaler, inklusive kostkomponenter, som finns i livmoderns miljö kan inducera betydande förändringar i uttrycket av genomet genom epigenetiska modifieringar. Fostrets utvecklingsplastiska reaktioner kan orsaka förändringar i mager kroppsmassa, endokrinologi, blodflöde och vaskulär belastning och leda till ökad risk för olika sjukdomar i vuxen ålder.
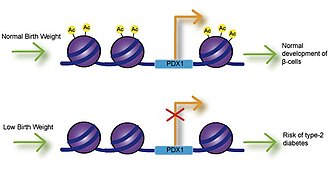
Låg födelsevikt
Fosterexponering för kalcium, folat, magnesium, högt eller lågt protein och zink har alla associerats med födelsevikt. Flera studier har undersökt sambandet mellan födelsevikt och risk för sjukdom och har funnit att låg födelsevikt är signifikant associerat med kranskärlssjukdom, stroke och typ-2 diabetes. Viktigast av allt, dessa associationer inträffade efter justering för livsstilsfaktorer, vilket innebär en genetisk grund för uppkomsten av sjukdom. Försämrad insulinutsöndring är förknippad med låg födelsevikt och kan leda till insulinresistens eftersom spädbarn samlar på sig kroppsfett. Studier som använder intrauterin tillväxtfördröjd (IUGR) råttor har funnit att tillväxthämning kan leda till minskat uttryck av Pdx1-transkriptionsfaktor, vilket är avgörande för differentiering och funktion av pankreatiska betaceller. Minskad histonacetylering vid den proximala promotorn av Pdx1 är ansvarig för minskat Pdx1-uttryck och resulterar därefter i en kaskad av histondeacetylering och metyleringshändelser som kan resultera i typ-2-diabetes.
Fetma
Fetma under graviditeten och maternal dieter med hög fetthalt visar båda starka samband med fetma hos avkommor. I takt med att antalet överviktiga kvinnor i reproduktiv ålder ökar, ökar också antalet överviktiga barn och spädbarn. Det har postulerats att maternell fetma orsakar en ansamling av fett i fetal fettvävnad (adiposity) och predisponerar spädbarn för fetma i barndomen och i vuxen ålder. Djurstudier har visat att moderns övernäring kan påverka hjärnans utveckling och orsaka störningar i programmeringen av hypotalamus . Avkommor som exponerades för en maternell kost med hög fetthalt eller hög kalorihalt hade ökade nivåer av insulin, glukos och leptin. Det antas att dessa förhöjningar beror på störningar i det komplexa neuronala nätverket som inkluderar neuropeptid Y (NPY) och proopiomelanocortin (POMC) vägar. Denna förändrade neuronala signalering kan följaktligen påverka matintagsbeteendet och leda till dietinducerad fetma i vuxen ålder. Medan epigenetiska modifieringar med största sannolikhet är involverade i utvecklingen av fetma, har de specifika målgenerna ännu inte identifierats. Gener involverade i adipogenes, såsom fibroblasttillväxtfaktor-2, fosfatas- och tensinhomolog, cyklinberoende kinashämmare 1A och östrogenreceptor-alfa, har flera CpG-öar i sina promotorställen och kan fungera som epigenetiska mål. Vidare har det visats att prenatal exponering för ett hypometylerande medel, såsom bisfenol A (BPA), är associerat med ökad kroppsvikt och antyder modifierad DNA-metylering som en mekanism för att öka mottagligheten för fetma.
Folat
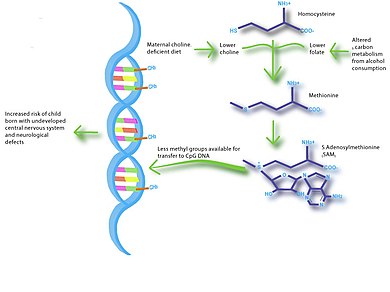
Man har länge insett att moderns folatintag under graviditeten är kopplat till fostrets utveckling och tillväxt, och kan minska risken för allvarliga fosterskador. Folat är en källa till S-adenosylmetionin (SAM), som används för att förse DNA-metyltransferaser med metylgrupper. Därför har förändringar i folattillförsel en betydande effekt på DNA-metyleringsmönster. Låga nivåer av folat är förknippade med en ökad risk för för tidig förlossning, dålig tillväxt av moderkakan och livmodern och intrauterin tillväxthämning. Flera komplexa sjukdomar, inklusive cancer, hjärt-kärlsjukdomar och autism har också kopplats till moderns folatstatus. Baserat på djurstudier har det antagits att minskat folatintag kan öka risken för neuralrörsdefekter genom att minska mängden metylayed DNA under kranial neuralrörsstängning. Nyligen upptäcktes att folatskydd från medfödda hjärtfel är kopplat till epigenetik och Wnt-signalering. Flera miljöfaktorer riktar sig mot Wnt-signalvägen under embryogenes och kan orsaka felreglering av vägen. Folsyrametabolism genererar SAM, vilket förändrar metyleringstillstånden för histonerna H3K9, H3K4 och H3K27 och förändrar Wnt-signalering genetiskt.
Nyligen visade en dubbelblind placebokontrollerad studie av högdos folinsyra (Leucovorin Calcium) effektivitet för att förbättra verbal kommunikation hos barn med autism .
Perinatal
Ett annat kritiskt utvecklingstidsfönster är perinatalperioden, tidsperioden omedelbart före och efter födseln. Det har visat sig att moderns kost i slutet av graviditeten och ett spädbarns kost under de första veckorna alla kan ha betydande effekter på genuttrycket. Därför är perinatal nutrition både sent i livmodern och amning.
Benhälsa
Benmassa och utveckling av osteoporos har studerats i relation till perinatal nutrition. En viktig faktor att tänka på när man undersöker perinatal nutrition är om barnet ammades eller matades med formel. Studier har visat att ammade barn har ökad benmassa jämfört med de som inte ammades, och att denna lilla ökning av benmassan under en period av kritisk utveckling potentiellt kan programmera skelettet att fortsätta längs en "hälsosam" tillväxtbana. Det har också visat sig att moderns D- vitaminbrist under sen graviditet är associerad med minskad benstorlek och mineralmassa i sen barndom. Toppbenmassa har visat sig vara en bra prediktor för risk för fraktur och osteoporos, med även en liten ökning av toppbenmassa som resulterar i en mycket lägre risk för benfraktur. Forskning visar att genetiska markörer endast förklarar en liten del av variationen i benmassa och risk för frakturer. Därför är hälsosam benprogrammering troligen påverkad av olika epigenetiska mekanismer, såsom prägling av de tillväxtfrämjande generna IGF-2, eller förändringar av hypotalamus- hypofys-binjureaxeln (HPA).
Neuroutveckling
Obalanser i moderns näring kan också ha en betydande effekt på fostrets neuroutveckling . Hjärnans utveckling sker snabbast under fosterutveckling och spädbarnsålder, och forskning har visat att exponering för vissa miljöförhållanden kan ha långvariga effekter på kognition . Specifikt har n-3- fettsyror , jod , järn och kolin visat sig påverka hjärnans utveckling och påverka kognitiva förmåga och beteende. De största bevisen för ett samband mellan kost och neuroutveckling kommer från studier som visar låg födelsevikt associerad med låg IQ och ökad risk för schizofreni . Flera studier tyder på att amning främjar långsiktig neuroutveckling genom att tillhandahålla de näringsämnen som är nödvändiga för korrekt hjärnutveckling. En studie på möss visade att dieter med kolinbrist under den sena graviditetsperioden försämrade fostrets hjärnutveckling, inklusive minskad cellproliferation och minskat visuellt-spatialt och auditivt minne. Dessa kognitiva förändringar verkade bero på förändrade histon- och DNA-metyleringsmönster i fostrets hippocampus , vilket ger en koppling mellan moderns näring, epigenetik och tidig hjärnutveckling.
Typ 1-diabetes
Det har postulerats att amning också kan skydda mot typ-1-diabetes, med forskning som visar att spädbarn som fått mjölkersättning löper en ökad risk att utveckla ö- autoantikroppar . Individer med typ 1-diabetes upplever en preklinisk diabetesfas som kännetecknas av autoimmunitet mot pankreasöar . Introduktionen av vissa livsmedel under de första månaderna av livet, såsom bär och spannmål, är signifikant förknippad med ökad risk för utveckling av autoantikroppar på öar jämfört med spädbarn som utsätts för fast föda senare i livet. Även om patogenesen bakom utvecklingen av autoantikroppar i stort sett fortfarande är okänd, är det mycket troligt att det finns en epigenetisk koppling mellan perinatal kost och risken för typ-1-diabetes.
Vuxen ålder
Majoriteten av forskningen inom nutriepigenomik har fokuserat på näringsobalanser under dräktighets- och amningsperioder. Men livsmedel som konsumeras under vuxen ålder kan också påverka genuttryck och sjukdomspatogenes. Cancer är den sjukdom som oftast förknippas med vuxennäring och epigenetiska modifieringar. DNA-hypometelering främjar cancerprogression genom att tillåta ökad gentranskription, medan hypermetylering kan tysta tumörsuppressorgener och ytterligare främja okontrollerad celldelning och tumörbildning . Föreningar som finns i livsmedel, såsom genistein och tepolyfenoler , kan reglera DNA-metyltransferaser och histonacetylering i odlade cancerceller och kan ge skydd mot vissa typer av cancer. Andra dietföreningar, såsom diallyldisulfid som finns i vitlök och sulforafan som finns i korsblommiga grönsaker, har associerats med cancerförebyggande i kliniska prövningar. Detta kan bero på deras förmåga att hämma histondeacetylas (HDAC) enzymer och förhindra tystnad av viktiga regulatoriska gener.
Generationsöverskridande effekter
Många tror att epigenetisk reglering rensas under befruktningsprocessen , men ännu fler bevis för transgenerationella effekter (TGE) avslöjas. Dessa TGE:n äger rum när de epigenetiska regleringsmönstren inte är tillräckligt raderade under befruktningen, möjligen på grund av näringsnivåer i tidigare generationer. Senare generationer kan påverkas av kalori- och proteinrestriktioner, fettrika interventioner och endokrina störningar i tidigare generationer. Skillnader i näringsbeteendet hos moderråttan tros orsaka felprogrammering i F1-generationen och kan sedan överföras till efterföljande generationer. Maternala råttor som fick en PR-diet under hela graviditeten ledde till metaboliska problem i F1- och F2-generationerna, även med normal näring under F1-graviditeten. Dessa effekter har också setts i F3-generationen beroende på längden på proteinrestriktionen. Om proteinrestriktion inträffade enbart under graviditeten, hade F1- och F2-avkommorna högre systoliskt blodtryck och lägre nefronantal, vilket möjligen predisponerade dem för hypertoni. Förändrad glukosutnyttjande upptäcktes hos avkommor till moderråttor som fick en PR-diet under graviditet och amning, vilket potentiellt kan leda till diabetes senare i livet
Proteinrestriktion i F0-generationen ledde till hypometylering av promotorer involverade i metabolism i F1- och F2-generationerna, även om den gravida F1-råttan fick en normal diet. Den exakta mekanismen för denna situation har ännu inte klarlagts; men direkt överföring är en distinkt möjlighet, vilket betyder att de epigenetiska märkena bevarades under spermatogenes och oogenes , när de normalt raderas.
Modeller som används i nutriepigenomiska studier
Den mesta forskningen hittills använder vanliga gnagarmodeller för att undersöka näringens roll för fenotypen . Populära områden att undersöka inkluderar IUGR-studier, där gnagare, och ibland får, utsätts för en mängd olika näringsförhållanden. En modell för att studera IUGR hos gnagare utvecklades av Simmons et al. (2010) och används för att undersöka typ II-diabetes. Maternal råttorna har sina livmoderartärer ligerade, vilket orsakar förändrad användning av glukos och insulin hos fostret och kan därför tjäna som modell för diabetes. Dessa tillväxthämmade råttor visade sig vara mycket lika mänskliga foster, eftersom de båda uppvisar symtom som sänkta glukos- och insulinnivåer. Graviditetsdiabetes kan också studeras genom kemisk induktion med streptozotocinbehandling av gravida råttor. Streptozotocin kan orsaka förstörelse av betacellerna i bukspottkörteln beroende på den angivna koncentrationen.
Det dominerande sättet att undersöka nutriepigenetiken innebär att variera de näringsförhållanden som en patient utsätts för och att övervaka effekterna därefter. Att begränsa kalori- och proteinintaget är de två vanligaste metoderna. En gravid gnagare kan få sitt kaloriintag minskat med upp till 30-50 % av det normala intaget. Proteinbegränsade gnagare ges 8-9% kasein , i motsats till kontrollråttor som matas med 20% kasein. Mikronäringsämnen, såsom zink och järn, kan också begränsas för att undersöka effekterna på avkomman. Dessutom används ofta råttor som matats med dieter som saknar eller inkluderar metyldonatorer för att studera kostens effekter på epigenomik, eftersom variationer inom metyleringen av DNA är vanliga sätt att tysta eller uttrycka gener. Att komplettera möss med folsyra, vitamin B12 , kolin och betain leder till ökade nivåer av DNA-metylering vid CpG-ställen och orsakar en pälsfärgförändring. Detta är ett exempel på epigenetiskt modifierbara loci som kallas en "metastabil epiallel", av vilka endast ett fåtal har identifierats. Ovanstående är ett exempel på "agouti"-genlokuset, varvid införandet av ett transposerbart element uppströms till Agouti-genen hypermetyleras från tillskottet och orsakar en förändring i mössens pälsfärg. Dieter som innehåller högre kolhydrater och fetter försöker efterlikna typiska dieter i västerländsk stil kan också användas i nutriepigenetiska studier. En annan metod som används är "catch-up", där avkommor från råttor födda till mödrar som utsätts för olika dieter sedan korsfostras till mödrar som matas med normal diet.
Framtida inriktningar
Möjligheterna att använda nutriepigenomics för intervention är ganska expansiva. Detta kan inkludera förebyggande terapier, som att tillhandahålla en optimal kost för näring under graviditet och amning. Det är redan vanligt att gravida mödrar kompletterar sin kost med kolin och folat för att förhindra utvecklingen av neurologiska funktionsnedsättningar hos fostret.
En mycket specifik diet, kallad "EpiG-diet", kan användas för en individ som tros ha högre risk att utveckla en metabolisk störning. Dessa dieter kan innefatta tillskott med metyldonatorer, såsom folat. Det finns också många andra naturliga föreningar, såsom resveratrol , curcumin och grönt te som har kallats "epigenetiska modifierare", eftersom de har anti-cancerförmåga förutom att de används som behandlingar för metabola sjukdomar. Men funktionerna hos dessa föreningar kräver fortfarande långtidsstudier för att utvärdera deras effekt över tid.
Det finns också potential för terapeutiska behandlingar som kan korrigera metabola störningar, såsom typ II-diabetes. Komponenter av vitlök och korsblommiga grönsaker är kända för att ha HDAC-hämmare som modifierar acetyleringen av histonproteiner och kan innehålla ett skydd mot cancer. Samma föreningar har också varit inblandade i colon irritabile (IBS) och tjocktarmscancer , eftersom de kan modifiera de histoner som normalt är inblandade i dessa sjukdomar.
Belysning av sjukdomsvägar är en annan framtida riktning för nutriepigenomiska studier. Till exempel kan kolinbristkost och alkoholmetabolism under graviditeten ha mycket liknande metaboliska vägar. Därför kan djurstudier med kolinbegränsade dieter hjälpa till vid undersökningar av fetala alkoholspektrumstörningar .
Jämfört med studier av maternell överföring saknas undersökningar av rollen av faderns dieter. En granskning visade att näringen hos båda föräldrarna faktiskt spelar en roll för att bestämma hälsan hos deras avkomma. En könslinjestudie rapporterade att råttor som fick en diet med hög fetthalt ledde till insulindysfunktion hos F1-avkommorna. Även om detta sannolikt sker via epigenetiska modifieringar som liknar de som postuleras i moderns dieter, återstår den exakta mekanismen att definieras. Att bedöma rollen av epigenetiska mekanismer kan vara lättare med hjälp av faderligt arv, eftersom spermier överför epigenetisk och genetisk information, medan de kvinnliga cellerna också överför mitokondriellt DNA .