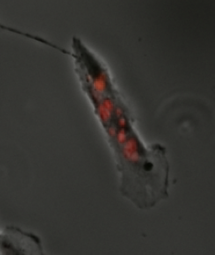
Mitotisk katastrof
Mitotisk katastrof har definierats som antingen en cellulär mekanism för att förhindra potentiellt cancerceller från att föröka sig eller som ett sätt av celldöd som inträffar efter felaktig cellcykelprogression eller inträde. Mitotisk katastrof kan induceras av förlängd aktivering av spindelmonteringskontrollpunkten , fel i mitos eller DNA-skada och fungerade för att förhindra genomisk instabilitet. Det är en mekanism som undersöks som ett potentiellt terapeutiskt mål i cancer , och många godkända terapier framkallar mitotisk katastrof.
Termanvändning
Flera försök att specifikt definiera mitotisk katastrof har gjorts sedan termen först användes för att beskriva en temperaturberoende dödlighet i jästen, Schizosaccharomyces pombe , som visade onormal segregation av kromosomer. Termen har använts för att definiera en mekanism för celldöd som inträffar medan en cell är i mitos eller som en metod för onkosuppression som förhindrar potentiellt tumörframkallande celler från att dela sig. Denna onkosuppression åstadkoms genom att initiera en form av celldöd såsom apoptos eller nekros eller genom att inducera cellulär åldrande .
Mekanism för att förhindra cancerutveckling
En användning av termen mitotisk katastrof är att beskriva en onkosuppressiv mekanism (dvs. en mekanism för att förhindra spridning av cancerceller och utveckling av tumörer) som uppstår när celler genomgår och upptäcker en defekt mitos har inträffat. Denna definition av denna mekanism har beskrivits av den internationella nomenklaturkommittén för celldöd. Enligt denna definition, celler som genomgår mitotisk katastrof antingen åldras och slutar dela sig eller genomgår en reglerad form av celldöd under mitos eller annan form av celldöd i nästa G1-fas av cellcykeln. Funktionen av denna mekanism är att förhindra celler från att utveckla genomisk instabilitet som kan leda till tumörbildning.
När cellen genomgår celldöd under mitos kallas detta mitotisk död. Detta kännetecknas av höga nivåer av cyklin B1 som fortfarande finns i cellen vid tidpunkten för celldöd, vilket tyder på att cellen aldrig avslutade mitosen. Mitotisk katastrof kan också leda till att cellen blir utsatt för celldöd genom apoptos eller nekros efter interfas i cellcykeln. Tidpunkten för celldöd kan dock variera från timmar efter att mitosen slutförts till år senare som har setts i mänskliga vävnader som behandlats med strålbehandling. Det minst vanliga resultatet av mitotisk katastrof är senescens där cellen slutar dela sig och går in i ett permanent cellcykelstopp som förhindrar cellen från att föröka sig ytterligare.
Mekanism för celldöd
En annan användning av termen mitotisk katastrof är att beskriva ett sätt för celldöd som inträffar under mitos. Denna celldöd kan uppstå på grund av en ansamling av DNA-skada i närvaro av felaktigt fungerande DNA-strukturkontrollpunkter eller en felaktigt fungerande kontrollpunkt för spindelsammansättning. Celler som genomgår mitotisk katastrofdöd kan sakna aktivering av vägar för de traditionella dödsvägarna såsom apoptos. Medan nyare definitioner av mitotisk katastrof inte använder det för att beskriva en bona fide celldödsmekanism, beskriver vissa publikationer det som en mekanism för celldöd.
Orsaker
Långvarig aktivering av spindelmonteringskontrollpunkten
Celler har en mekanism för att förhindra felaktig segregering av kromosomer , känd som spindelmonteringskontrollpunkten eller mitotisk kontrollpunkt. Kontrollpunkten för spindelsammansättningen verifierar att mitotiska spindlar har fästs ordentligt vid kinetokorerna i varje kromosompar innan kromosomerna segregerar under celldelningen. Om de mitotiska spindlarna inte är ordentligt fästa vid kinetokorerna kommer kontrollpunkten för spindelmonteringen att förhindra övergången från metafas till anafas . Denna mekanism är viktig för att säkerställa att DNA i cellen delas lika mellan de två dottercellerna. När kontrollpunkten för spindelsammansättningen aktiveras, stoppar den cellen i mitos tills alla kromosomer är ordentligt fästa och inriktade. Om kontrollpunkten är aktiverad under en längre period kan det leda till mitotisk katastrof.
Långvarig aktivering av spindelmonteringskontrollpunkten hämmar det anafasfrämjande komplexet. Normalt leder aktivering av det anafasfrämjande komplexet till separation av systerkromatider och cellen som lämnar mitosen. Det mitotiska kontrollpunktskomplexet fungerar som en negativ regulator av det anafasfrämjande komplexet. Obundna kinetokorer främjar bildandet av det mitotiska kontrollpunktskomplexet som är sammansatt av fyra olika proteiner kända som Mad2 , Cdc20 , BubR1 och Bub3 hos människor. När det mitotiska kontrollpunktskomplexet bildas, binder det till det anafasfrämjande komplexet och förhindrar dess förmåga att främja cellcykelprogression.
Fel i mitos
Vissa celler kan ha en felaktig mitos men ändå överleva och genomgå en annan celldelning som gör att cellen är mer sannolikt att genomgå mitotisk katastrof. Till exempel kan celler genomgå en process som kallas mitotisk glidning där celler lämnar mitos för tidigt innan mitosprocessen är avslutad. I detta fall avslutar cellen mitos i närvaro av spindelmonteringskontrollpunktsignalering som normalt skulle förhindra cellen från att lämna mitosen. Detta fenomen orsakas av felaktig nedbrytning av cyklin B1 och kan resultera i kromosomfelsegregeringshändelser. Cyclin B1 är en viktig regulator av cellcykeln och styr cellernas utveckling från G2- till M-fas. Cyclin B1 arbetar med sin bindningspartner CDK1 för att kontrollera denna utveckling och komplexet är känt som den mitotiska främjande faktorn. Medan den mitotiska befrämjande faktorn används för att styra cellernas inträde i mitos, styr dess förstörelse också cellerna att lämna mitosen. Normalt initieras cyklin B1-nedbrytning av det anafasfrämjande komplexet efter att alla kinetokorer har fästs ordentligt av mitotiska spindelfibrer. Men när cyklin B1-nivåerna bryts ned till snabba kan detta resultera i att cellen lämnar mitosen i förtid vilket resulterar i potentiella mitotiska fel inklusive felsegregering av kromosomer.
Tetraploida eller på annat sätt aneuploida celler löper högre risk för mitotisk katastrof. Tetraploida celler är celler som har duplicerat sitt genetiska material, men som inte har genomgått cytokines för att splittras i två dotterceller och därmed förbli som en cell. Aneuploida celler är celler som har ett felaktigt antal kromosomer inklusive hela tillägg av kromosomer eller fullständiga förluster av kromosomer. Celler med ett onormalt antal kromosomer är mer benägna att ha kromosomsegregationsfel som resulterar i mitotisk katastrof. Celler som blir aneuploida förhindras ofta från ytterligare celltillväxt och delning genom aktivering av tumörsuppressorvägar såsom p53 som driver cellen till ett icke-prolifererande tillstånd känt som cellulär senescens. Med tanke på att aneuploida celler ofta kan bli tumörframkallande, förhindrar denna mekanism förökningen av dessa celler och förhindrar därmed utvecklingen av cancer i organismen.
Celler som genomgår multipolära divisioner, eller med andra ord delas upp i mer än 2 dotterceller, löper också en högre risk för mitotisk katastrof. Medan många av avkomman till multipolära divisioner inte överlever gör det till mycket obalanserade kromosomantal, kommer de flesta celler som överlever och genomgår en efterföljande mitos sannolikt att uppleva en mitotisk katastrof. Dessa multipolära uppdelningar uppstår på grund av närvaron av mer än två centrosomer. Centrosomer är cellulära organeller som verkar för att organisera den mitotiska spindelsammansättningen i cellen under mitos och på så sätt styr segregeringen av kromosomer under mitos. Normalt kommer celler att ha två centrosomer som styr systerkromatider till motsatta poler av den delande cellen. Men när det finns mer än två centrosomer närvarande i mitos kan de dra kromosomer i felaktiga riktningar vilket resulterar i dotterceller som är oöverkomliga. Många cancerformer har ett för stort antal centrosomer, men för att förhindra oöverkomliga dotterceller har cancercellerna utvecklat mekanismer för att gruppera sina centrosomer. När centrosomerna är klustrade till två poler i den delande cellen, segregeras kromosomerna ordentligt och två dotterceller bildas. Således kan cancer som kan anpassa sig till ett högre antal centrosomer förhindra mitotisk katastrof och föröka sig i närvaro av deras extra centrosomer.
DNA-skada
Höga nivåer av DNA-skador som inte repareras innan cellen går in i mitos kan resultera i en mitotisk katastrof. Celler som har en komprometterad G2-kontrollpunkt har inte förmågan att förhindra progression genom cellcykeln även när det finns DNA-skador i cellens arvsmassa. G2-kontrollpunkten fungerar normalt för att stoppa celler som har skadat DNA från att utvecklas till mitos. G2 -kontrollpunkten kan äventyras om tumörsuppressor p53 inte längre finns i cellen. Svaret på DNA-skada som finns under mitos skiljer sig från svaret på DNA-skada som upptäckts under resten av cellcykeln. Celler kan upptäcka DNA-defekter under resten av cellcykeln och antingen reparera dem om möjligt eller genomgå apoptos av senescens. Med tanke på att när detta händer cellen inte utvecklas till mitos anses det inte vara en mitotisk katastrof.
Mitotisk katastrof i cancer
Förebyggande av genomisk instabilitet
Genomisk instabilitet är ett av cancercellers kännetecken och främjar genetiska förändringar (både stora kromosomförändringar såväl som individuella nukleotidförändringar) i cancerceller vilket kan leda till ökade nivåer av tumörprogression genom genetisk variation i tumörcellen. Cancer med en högre nivå av genomisk instabilitet har visat sig ha sämre patientresultat än de cancerformer som har lägre nivåer av genomisk instabilitet. Celler har fått mekanismer som motstår ökad genomisk instabilitet i celler. Mitotisk katastrof är ett sätt på vilket celler förhindrar förökningen av genomiskt instabila celler. Om mitotisk katastrof misslyckas för celler vars genom har blivit instabilt kan de föröka sig okontrollerat och potentiellt bli tumörframkallande.
Nivån av genomisk instabilitet är olika mellan cancertyper med epiteliala cancerformer som är mer genomiskt instabila än cancer av hematologiskt eller mesenkymalt ursprung. Mesoteliom , småcellig lungcancer , bröst- , äggstockscancer , icke-småcellig lungcancer och levercancer uppvisar höga nivåer av genomisk instabilitet medan akut lymfoblastisk leukemi , myelodysplasi och myeloproliferativ störning har lägre nivåer av instabilitet.
Läkemedel mot cancer
Främjande av mitotisk katastrof i cancerceller är ett område av cancerterapeutisk forskning som har väckt intresse och ses som ett potentiellt mål för att övervinna resistens som utvecklats mot nuvarande kemoterapier. Cancerceller har visat sig vara mer känsliga för induktion av mitotisk katastrof än icke-cancerceller i kroppen. Tumörceller har ofta inaktiverat maskineriet som krävs för apoptos, såsom p53-proteinet. Detta uppnås vanligtvis genom mutationer i p53-proteinet eller genom förlust av kromosomregionen som innehåller den genetiska koden för det. p53 verkar för att förhindra spridning av tumörceller och anses vara ett stort tumörsuppressorprotein. p53 fungerar genom att antingen stoppa utvecklingen genom cellcykeln när okontrollerad celldelning känns av eller så kan det främja celldöd genom apoptos i närvaro av irreparabel DNA-skada. Mitotisk katastrof kan inträffa på ett p53-oberoende sätt och utgör således en terapeutisk väg av intresse. Dessutom har doser av DNA-skadande läkemedel som är lägre än dödliga nivåer visat sig inducera mitotisk katastrof. Detta skulle möjliggöra administrering av ett läkemedel medan patienten har färre biverkningar.
Cancerterapier kan inducera mitotisk katastrof genom att antingen skada cellens DNA eller hämma spindelsammansättningen. Läkemedel, kända som spindelgifter, påverkar polymerisationen eller depolymerisationen av mikrotubulusspindlar och stör på så sätt den korrekta bildningen av de mitotiska spindlarna. När detta händer aktiveras spindelmonteringskontrollpunkten och övergången från metafas till anafas inhiberas.
| Läkemedel | Godkända användningar / klinisk prövningsfas / forskningsanvändning | Handlingsmekanism |
|---|---|---|
| Paklitaxel | Godkänd användning: AIDS-relaterat Kaposi-sarkom , bröstcancer , icke-småcellig lungcancer och äggstockscancer | Främjar montering av mikrotubulusspindeln och förhindrar att mikrotubuli lossnar vilket förhindrar cellen från att korrekt komma in i eller ut ur mitos. |
| Docetaxel | Godkänd användning: Bröstcancer, icke-småcellig lungcancer, prostatacancer , skivepitelcancer i huvud och hals , adenokarcinom i magen och adenokarcinom i gastroesofageal junction | |
| Vinblastin | Godkänd användning: Bröstcancer, Choriocarcinom , Hodgkin-lymfom , Kaposi-sarkom, mycosis fungoides , non-Hodgkin-lymfom , testikulära könscellstumörer | Depolymeriserar mikrotubuli |
| Vinkristine | Godkänd användning: Akut lymfatisk leukemi , lymfom , neuroblastom , sarkom och tumörer i centrala nervsystemet | |
| Monastrol | Forskningsanvändning | EG5- hämmare som stör kromosomernas rörelse under mitos. Denna störning resulterar i att celler dör i mitos eller i efterföljande interfas. |
| ARRY-520 (Filanesib) | Fas III klinisk prövning : multipelt myelom | |
| VX-680 | Preklinisk forskning | AURKA / AURKB -hämmare som stör rörelsen av kromosomer och cytoskelettet under mitos |
| MLN8237 | Fas I klinisk prövning: pediatriska återkommande atypiska teratoida rhabdoida tumörer och pediatriskt avancerade solida tumörer Misslyckad klinisk prövning för vuxna lymfom och lungcancer |
Se även
- ^ Galluzzi, Lorenzo; Vitale, Ilio; Aaronson, Stuart A.; Abrams, John M.; Adam, Dieter; Agostinis, Patrizia; Alnemri, Emad S.; Altucci, Lucia; Amelio, Ivano; Andrews, David W.; Annicchiarico-Petruzzelli, Margherita; Antonov, Alexey V.; Arama, Eli; Baehrecke, Eric H.; Barlev, Nickolai A. (mars 2018). "Molekylära mekanismer för celldöd: rekommendationer från nomenklaturkommittén för celldöd 2018" . Celldöd & differentiering . 25 (3): 486–541. doi : 10.1038/s41418-017-0012-4 . ISSN 1476-5403 . PMC 5864239 . PMID 29362479 .
- ^ a b c d Castedo, Maria; Perfettini, Jean-Luc; Roumier, Thomas; Andreau, Karine; Medema, Rene; Kroemer, Guido (april 2004). "Celldöd genom mitotisk katastrof: en molekylär definition" . Onkogen . 23 (16): 2825–2837. doi : 10.1038/sj.onc.1207528 . ISSN 1476-5594 . PMID 15077146 . S2CID 28061417 .
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj Vitale, Ilio; Galluzzi, Lorenzo; Castedo, Maria; Kroemer, Guido (juni 2011). "Mitotisk katastrof: en mekanism för att undvika genomisk instabilitet" . Naturrecensioner Molekylär cellbiologi . 12 (6): 385–392. doi : 10.1038/nrm3115 . ISSN 1471-0080 . PMID 21527953 . S2CID 22483746 .
- ^ a b c d e f g h i j k l m n o p q Denisenko, Tatiana V.; Sorokina, Irina V.; Gogvadze, Vladimir; Zhivotovsky, Boris (januari 2016). "Mitotisk katastrof och cancerläkemedelsresistens: En länk som måste brytas" . Uppdateringar om läkemedelsresistens: recensioner och kommentarer i antimikrobiell och anticancerkemoterapi . 24 : 1–12. doi : 10.1016/j.drup.2015.11.002 . ISSN 1532-2084 . PMID 26830311 .
- ^ a b c d Galluzzi, Lorenzo; Vitale, Ilio; Aaronson, Stuart A.; Abrams, John M.; Adam, Dieter; Agostinis, Patrizia; Alnemri, Emad S.; Altucci, Lucia; Amelio, Ivano; Andrews, David W.; Annicchiarico-Petruzzelli, Margherita; Antonov, Alexey V.; Arama, Eli; Baehrecke, Eric H.; Barlev, Nickolai A. (mars 2018). "Molekylära mekanismer för celldöd: rekommendationer från nomenklaturkommittén för celldöd 2018" . Celldöd & differentiering . 25 (3): 486–541. doi : 10.1038/s41418-017-0012-4 . ISSN 1476-5403 . PMC 5864239 . PMID 29362479 .
- ^ a b c d e Mc Gee, Margaret M. (2015). "Inriktning mot den mitotiska katastrofens signaleringsväg i cancer" . Förmedlare av inflammation . 2015 : 146282. doi : 10.1155/2015/146282 . ISSN 1466-1861 . PMC 4600505 . PMID 26491220 .
- ^ a b Fu, Xiao; Li, Mu; Tang, Cuilian; Huang, Zezhi; Najafi, Masoud (december 2021). "Inriktning på cancercelldödsmekanismer av resveratrol: en översyn" . Apoptos . 26 (11–12): 561–573. doi : 10.1007/s10495-021-01689-7 . ISSN 1573-675X . PMID 34561763 . S2CID 237627882 .
- ^ Sazonova, Elena V.; Petrichuk, Svetlana V.; Kopeina, Gelina S.; Zhivotovsky, Boris (2021-12-09). "En koppling mellan mitotiska defekter och mitotisk katastrof: upptäckt och cellöde" . Biologi direkt . 16 (1): 25. doi : 10.1186/s13062-021-00313-7 . ISSN 1745-6150 . PMC 8656038 . PMID 34886882 .
- ^ a b c d Lara-Gonzalez, Pablo; Pines, Jonathan; Desai, Arshad (september 2021). "Aktivering och ljuddämpning av spindelmonteringskontrollpunkt vid kinetochorer" . Seminarier i cell- och utvecklingsbiologi . 117 : 86–98. doi : 10.1016/j.semcdb.2021.06.009 . ISSN 1096-3634 . PMC 8406419 . PMID 34210579 .
- ^ Sinha, Debottam; Duijf, Pascal HG; Khanna, Kum Kum (2019-01-02). "Mitotisk glidning: en gammal berättelse med en ny twist" . Cellcykel . 18 (1): 7–15. doi : 10.1080/15384101.2018.1559557 . ISSN 1538-4101 . PMC 6343733 . PMID 30601084 .
- ^ a b c d e Ghelli Luserna di Rorà, Andrea; Martinelli, Giovanni; Simonetti, Giorgia (2019-11-26). "Balansen mellan mitotisk död och mitotisk glidning vid akut leukemi: ett nytt terapeutiskt fönster?" . Journal of Hematology & Oncology . 12 (1): 123. doi : 10.1186/s13045-019-0808-4 . ISSN 1756-8722 . PMC 6880427 . PMID 31771633 .
- ^ a b c d Ganem, Neil J; Storchova, Zuzana; Pellman, David (2007-04-01). "Tetraploidi, aneuploidi och cancer" . Aktuell åsikt inom genetik och utveckling . Kromosomer och uttrycksmekanismer. 17 (2): 157–162. doi : 10.1016/j.gde.2007.02.011 . ISSN 0959-437X . PMID 17324569 .
- ^ Ben-David, Uri; Amon, Angelika (januari 2020). "Kontext är allt: aneuploidi vid cancer" . Naturrecensioner. Genetik . 21 (1): 44–62. doi : 10.1038/s41576-019-0171-x . hdl : 1721.1/126231 . ISSN 1471-0064 . PMID 31548659 . S2CID 202746570 .
- ^ Ogden, A; Rida, PCG; Aneja, R (augusti 2012). "Låt oss krypa ihop oss för att förhindra en röra: centrosomdeklustering som en attraktiv anticancerstrategi" . Celldöd och differentiering . 19 (8): 1255–1267. doi : 10.1038/cdd.2012.61 . ISSN 1350-9047 . PMC 3392635 . PMID 22653338 .
- ^ Bornens, Michel (2021-02-01). "Centrosom organisation och funktioner" . Aktuell åsikt i strukturbiologi . Centrosomal organisation och sammansättningar ● Vikning och bindning. 66 : 199-206. doi : 10.1016/j.sbi.2020.11.002 . ISSN 0959-440X . PMID 33338884 . S2CID 229324538 .
- ^ Doxsey, Stephen; Zimmerman, Wendy; Mikule, Keith (juni 2005). "Centrosomkontroll av cellcykeln" . Trender inom cellbiologi . 15 (6): 303–311. doi : 10.1016/j.tcb.2005.04.008 . ISSN 0962-8924 . PMID 15953548 .
- ^ Stark, George R.; Taylor, William R. (2004), Schönthal, Axel H. (red.), "Analyzing the G2/M Checkpoint" , Checkpoint Controls and Cancer: Volume 1: Reviews and Model Systems , Totowa, NJ: Humana Press, vol. 280, s. 51–82, doi : 10.1385/1-59259-788-2:051 , ISBN 978-1-59259-788-8 , PMID 15187249 , hämtad 2022-11-26
- ^ Hanahan, Douglas (januari 2022). "Kräftans kännetecken: nya dimensioner" . Cancer Discovery . 12 (1): 31–46. doi : 10.1158/2159-8290.CD-21-1059 . ISSN 2159-8290 . PMID 35022204 . S2CID 245916132 .
- ^ Andor, Noemi; Maley, Carlo C.; Ji, Hanlee P. (2017-05-01). "Genomisk instabilitet i cancer: Vickar på gränsen för tolerans" . Cancerforskning . 77 (9): 2179–2185. doi : 10.1158/0008-5472.CAN-16-1553 . ISSN 0008-5472 . PMC 5413432 . PMID 28432052 .
- ^ a b Pikor, Larissa; tors, Kelsie; Vucic, Emily; Lam, Wan (2013). "Detekteringen och implikationen av genominstabilitet i cancer" . Cancer och metastaser recensioner . 32 (3): 341–352. doi : 10.1007/s10555-013-9429-5 . ISSN 0167-7659 . PMC 3843371 . PMID 23633034 .
- ^ a b c Kanapathipillai, Mathumai (2018-05-23). "Behandla p53 Mutant Aggregation-Associated Cancer" . Cancer . 10 (6): 154. doi : 10.3390/cancers10060154 . ISSN 2072-6694 . PMC 6025594 . PMID 29789497 .
- ^ "Paclitaxel" . National Cancer Institute . 5 oktober 2006 . Hämtad 2022-11-29 .
- ^ Zhu, Linyan; Chen, Liqun (2019-06-13). "Framsteg inom forskning om paklitaxel och tumörimmunterapi" . Cellular & Molecular Biology Letters . 24 : 40. doi : 10.1186/s11658-019-0164-y . ISSN 1425-8153 . PMC 6567594 . PMID 31223315 .
- ^ "Docetaxel - NCI" . www.cancer.gov . 2006-10-05 . Hämtad 2022-11-29 .
- ^ "Vinblastine Sulfate - NCI" . www.cancer.gov . 2011-02-03 . Hämtad 2022-11-29 .
- ^ Triarico, Silvia; Romano, Alberto; Attinà, Giorgio; Capozza, Michele Antonio; Maurizi, Palma; Mastrangelo, Stefano; Ruggiero, Antonio (2021-04-16). "Vinkristin-inducerad perifer neuropati (VIPN) i pediatriska tumörer: mekanismer, riskfaktorer, strategier för förebyggande och behandling" . International Journal of Molecular Sciences . 22 (8): 4112. doi : 10.3390/ijms22084112 . ISSN 1422-0067 . PMC 8073828 . PMID 33923421 .
- ^ a b Garcia-Saez, Isabel; Skoufias, Dimitrios A. (2021-02-01). "Eg5-målinriktade medel: Från ny upptäckt av antimitotiska hämmare till cancerterapi och resistens" . Biokemisk farmakologi . 184 : 114364. doi : 10.1016/j.bcp.2020.114364 . ISSN 0006-2952 . PMID 33310050 . S2CID 229180081 .
- ^ Rossari, Federico; Minutolo, Filippo; Orciuolo, Enrico (2018-06-20). "Forr, nutid och framtid för Bcr-Abl-hämmare: från kemisk utveckling till klinisk effekt" . Journal of Hematology & Oncology . 11 (1): 84. doi : 10.1186/s13045-018-0624-2 . ISSN 1756-8722 . PMC 6011351 . PMID 29925402 .
- ^ Mills, Christopher C.; Kolb, EA.; Sampson, Valerie B. (2017-12-01). "Recension: De senaste framstegen av cellcykelhämmande behandlingar för pediatrisk cancer" . Cancerforskning . 77 (23): 6489–6498. doi : 10.1158/0008-5472.CAN-17-2066 . ISSN 0008-5472 . PMC 5712276 . PMID 29097609 .