MTRR (gen)
| MTRR | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , MSR, cblE, 5-metyltetrahydrofolat-homocystein metyltransferasreduktas | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Metioninsyntasreduktas , även känt som MSR , är ett enzym som hos människor kodas av MTRR -genen .
Fungera
Metionin är en essentiell aminosyra som krävs för proteinsyntes och enkolsmetabolism. Dess syntes katalyseras av enzymet metioninsyntas . Metioninsyntas blir så småningom inaktivt på grund av oxidationen av dess kobalaminkofaktor . Metioninsyntasreduktas regenererar ett funktionellt metioninsyntas via reduktiv metylering. Det är en medlem av ferredoxin-NADP(+) reduktas (FNR) familjen av elektrontransferaser.
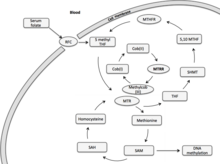
Metioninsyntasreduktas (MTRR) är primärt involverat i den reduktiva metyleringen av homocystein till metionin, med användning av metylkob(I)alamin som en mellanliggande metylbärare. Metionin är en essentiell aminosyra hos däggdjur, nödvändig för proteinsyntes och en kolmetabolism. I sin aktiverade form fungerar S-adenosylmetionin som en metyldonator i biologiska transmetyleringsreaktioner och som en propylamindonator vid polyaminsyntes. En huvudprodukt av metionindemetylering är homocystein. Remetylering av homocystein sker via ett kobalaminberoende enzym, metioninsyntas (MTR). Folatcykeln är kopplad till homocysteinmetabolism via MTR. Cirkulerande blodfolat (5-metyltetrahydrofolat, 5-MTHF) donerar metylgrupper till MTR för att användas i cellulär metylering. En metylkoboltbindning av den intermediära metylbäraren, metylkob(III)alamin, klyvs heterolytiskt och producerar kobalamin i dess mycket reaktiva oxidationstillstånd som kob(I)alamin. Den enzymbundna cob(I)alamin-kofaktorn av MTR-enzymet fungerar som en metylbärare mellan 5-MTHF och homocystein. Cob(I)alamin oxideras till cob(II)alamin ungefär en gång var 100:e metylöverföringscykel, vilket gör cob(I)alamin-MTR-enzymkomplexet inaktivt. Reaktivering av detta enzymkomplex sker genom reduktiv remetylering med MTRR, med användning av S-adenosylmetionin som en metyldonator. MTR-reaktivering kan också vara NADPH-beroende som involverar två redoxproteiner, lösligt cytokrom b5 och reduktas 1. Denna väg är dock ansvarig för en mindre roll i reaktivering, medan MTRR förblir en stor bidragande faktor i denna reduktiva reaktivering.
Biologiska processer som påverkas av MTRR inkluderar: svavelaminosyrametabolisk process, DNA-metylering, metioninmetabolisk process, metioninbiosyntetisk process, metylering, S-adenosylmetionincykel, homocysteinkatabolisk process, folsyrametabolisk process, oxidationsreduktionsprocess och negativ reglering av cystationin beta -syntasaktivitet.
MTRR-genen
Metioninsyntasreduktasgenen ( MTRR ) verkar primärt i den reduktiva regenereringen av cob(I)alamin (vitamin B12). Cob(I)alamin är en kofaktor som upprätthåller aktiveringen av metioninsyntasenzymet (MTR) Metioninsyntas , som länkar folat- och metioninmetabolismen. Donation av metylgrupper från folat används för cellulär och DNA-metylering, vilket påverkar epigenetisk nedärvning.
Alias
- 5-metyltetrahydrofolat-homocystein metyltransferasreduktas
- MSR
- [Metioninsyntas]- Kobalaminmetyltransferas (Cob(II)Alaminreducerande)
- Metioninsyntasreduktas, mitokondrie
- EC 1.16.1.8
- CblE
Kartläggning
Genen kartlades till human kromosom 5. Genspecifika primerpar resulterade i PCR-amplifiering av en produkt matchad efter storlek till en hybridkartläggningspanel innehållande endast kromosom 5 som sitt humana genetiska material. Produktens DNA-sekvens matchade företablerade genmarkörer specifika för denna kromosom. Exakt genens cytogena position bestämdes genom kartläggning till en artificiell kromosomkonstruktion innehållande genen via fluorescens in situ hybridisering. Den exakta MTRR-genplatsen kartlades till 5p15.3-p15.2.
Strukturera
MTRR-genen är associerad med en familj av elektrontransferaser som kallas Ferredoxin-NADP(+)-reduktas (FNR)-familjen. Finns i 15 primater och över 16 vävnader hos människor, MTRR är 34 kb lång. Genen omfattar 15 exoner och inkluderar många cytolosiska mitokondriella mRNA-isoformer. Flera kofaktorbindningsställen hjälper till att upprätthålla MTR-aktivitet via reduktiv remetylering. Alla bindande domäner involverar selektiva och icke-kovalenta interaktioner förutom flavodoxin_1-domänen.
Kofaktorbindningsställen
Flavodoxin-1-domän
Flavoproteiner är allestädes närvarande biokatalysatorer som binder specifika redoxaktiva protesgrupper. Domänen är associerad med elektronöverföringsproteiner och används i elektrontransportsystem. Kofaktorn flavin-mononukleotiden (FMN) är bunden icke-kovalent till domänen, som är funktionellt utbytbar med järn-svavelkonstituerade proteiner som reglerar elektronöverföring eller ferredoxiner.
FLUGA
Flavinadenindinukleotid i sin oxiderade form, FAD är en kofaktor av flavoproteinoxidoreduktasenzymer. Flavoprotein pyridin nukleotid cytokrom reduktaser, inklusive FAD katalyserar utbytet av reducerande ekvivalenter (H+ eller elektroner). Initiala elektrondonatorer och slutliga elektronacceptorer innefattar enskilda elektronbärare respektive två elektronbärande nikotinamiddinukleotider.
NAD
Evolutionärt konserverad proteindomän motsvarande oxidoreduktasaktivitet. NAD-bindning katalyserar redoxreaktioner för att ändra oxidationstillståndet för metalljoner, genom att använda NADP+ som en elektronacceptor.
Metioninsyntasreduktasaktivitet
Involverad i reduktiv remetylering av cob(II)alamin med användning av S-adenosylhomocystein som metyldonator. Katalyserar reaktionen:
[metioninsyntas]- kob(II)alamin + NADPH + H+ + S-adenosylmetionin → [metioninsyntas]-metylkob(I)alamin + S-adenosylhomocystein + NADP+.
Akvakobalaminreduktas (NADPH) aktivitet
Tillhör familjen oxidoreduktas, oxiderande metalljoner med NADP+ som fungerar som en elektronacceptor. Använder FAD som en kofaktor när den katalyserar följande reaktion:
2cob(II)alamin + NADP+ 2aquacob(III)alamin + NADPH + H+.
Flavinadenindinukleotid
Interagerar med kofaktorn eller protesgruppen, FAD av flavoproteiner och innehåller en flavindel i form av FAD eller FMN (flavinmononukleotid). Domänen binder icke-kovalent oxiderad FAD eller dess reducerade form, hydrokinon (FADH2).
FMN
Flavinmononukleotidbindande domän interagerar med ett koenzym av flavoproteinoxidoreduktasenzymer, FMN.
NADP
Nikotinamidadenindinukleotidfosfat är ett koenzym som finns i redox- och biosyntetiska reaktioner. Domänen binder NADP i dess oxiderade eller reducerade former som NADP+ respektive NADPH.
ADPH
Innebär en icke-kovalent och selektiv interaktion med den reducerade formen av NADP, NADPH.
NADPH-hemoproteinreduktasaktivitet
Domänen är associerad med oxidoreduktasfamiljen och verkar på NADH eller NADPH, med hjälp av ett hemprotein som elektronacceptor. Kräver FAD och FMN som kofaktorer för att katalysera reaktionen:
NADPH + H+ + n oxiderat hemoprotein = NADP+ + n reducerat hemoprotein.
Proteinbindning
Bindande domän involverad i interaktionen med proteiner eller proteinkomplex.
Polymorfismer
Patogena mutationer
- (MTRR):c.66A>G – Polymorfism som resulterar i isoleucinomvandling till metionin vid kodon 22. Denna mutation finns inom och påverkar den FMN-bindande domänen.
- (MTRR):c.524C>T – Serin till leucinsubstitution vid kodon 175. Benign mutation associerad med nedsatt intracellulär kobalaminmetabolismstörning.
- (MTRR):c.1049A>G – Lysin till argininsubstitution vid kodon 350.
- (MTRR):c.1349C>G – Prolin till argininsubstitution vid kodon 450. Prevalens associerad med onormala störningar i intracellulär kobalaminmetabolism.
- (MTRR):c.903+469T>C – Djup intronisk infogning mellan exon 6 och 7 (r.903_904ins140). Treonin till cystein förändring som resulterar i aktivering av en exon splitsningsförstärkare i intron 6.
- (MTRR):c.1361C>T – Sällsynt polymorfism som involverar serin till leucinsubstitution vid kodon 454. Känd som den iberiska mutationen, utbredd vid homocystinuri megaloblastisk anemi på grund av nedsatt kobalaminmetabolism. Främst tre olika halotyper (GTACG, GCACA, GCACG) från deaminering av metylcytosin i olika kromosomer.
- (MTRR):c.1459G>A – Innebär substitution av glycin till arginin vid kodon 487. Konserverad i MTRR och befunnits förekomma inom den FAD-bindande domänen. Patogenicitet associerad med medfödda genetiska sjukdomar.
- (MTRR):c.1573C>T – Argininsubstitution med ett prematurt termineringskodon vid kodon 525.
- (MTRR):c.1622_1623dupTA – Resulterar i bildning av ett prematurt termineringskodon. Patogenicitet associerad med CblE-typ av homocystinuri.
- (MTRR):r.1462_1557del96 – Förknippad med splitsning av exon 11 på grund av en 7 baspar deletion. En stor deletion av denna mutanta allel resulterar i frånvaron av en c-terminal i den FAD-bindande domänen. Patogenicitet associerad med CblE-typ av homocystinuri.
- (MTRR):c.1953-6_1953-2del5 – Ny mutation associerad med CblE-typ av homocystinuri. Instabilt mRNA som härrör från denna mutant resulterar i en frånvaro av mRNA som krävs för translation, vilket ger patogenicitet.
Mutationer involverade i bildandet av prematura termineringskodon resulterar i trunkerade muterade proteiner om de translateras. Mutanter uppvisar en frånvaro av FAD/NADPH-bindande domäner och instabilt mRNA på grund av nonsensförmedlat förfall (NMD). NMD finns inte i (MTRR):c.1573C>T eller (MTRR):c.1622_1623dupTA polymorfismer. Varianten (MTRR):c.903+469T>C är också associerad med bildningen av prematura termineringskodon.
Andra mutationer
- (MTRR):c.1911G>A ¬– Benign synonym mutation (alanin till alanin) vid kodon 637. Förknippad med störningar i kobalaminmetabolism.
Klinisk signifikans
Enkelnukleotidpolymorfismer (SNP) i MTRR-genen försämrar MTR-aktivitet, vilket resulterar i förhöjda homocysteinnivåer på grund av försämrad metylering till metionin. Förhöjda homocysteinnivåer är associerade med fosterskador förutom graviditetskomplikationer, hjärt-kärlsjukdomar, cancer, megaloblastisk anemi, Alzheimers sjukdomar och kognitiv dysfunktion hos äldre. Närvaro av den muterade varianten (66A>G) är associerad med signifikant lägre, upp till 4 gånger, plasmakobalamin- och folatnivåer hos hjärttransplanterade patienter. En åtföljande minskning av tillgängligheten av S-adenosylmetionin resulterar i DNA-hypometylering. Lågt folat begränsar en kolmetabolism och homocysteinmetabolism eftersom vitamin B12 interagerar med folat på denna väg. Dessutom är denna mutation associerad med en ökad risk för typ 2-diabetes.
Cancer
Specifika SNP är associerade med en förhöjd risk för lungcancer och interagerar med folatintag i denna etiologi. (MTRR):c.66A>G-mutationen relaterar till en signifikant ökning av risken för lungcancer. När den uttrycks samtidigt med polymorfismen (MTR): 2756A>G, ökar risken för lungcancer ytterligare på ett dosberoende sätt. Korrelation mellan denna polymorfism och ökad risk för lungcancer finns med lågt folatintag och högt vitamin B12, vilket tyder på en B12-oberoende verkningsmekanism. Denna mutation är också associerad med en ökad risk vid kolorektal cancer, akut lymfoblastisk leukemi, blåscancer, cervikal intraepitelial neoplasi, non-Hodgkin lymfom och esofagus skivepitelcancer.
CblE-typ av homocystinuri
Ommetylering av homocystein till metionin genom MTR kräver derivatet av kobalamin, metylkobalamin. Kobalaminmetabolism initieras av endocytos av kobalamin bundet till plasmaproteinet transkobalamin (II). Klyvning av detta komplex producerar fritt kobalamin, som translokerar från lysosom till cytoplasma. Omvandling kan ske till 5'-deoxiadenosylkobalamin (AdoCbl) som aktiverar mitokondriella enzymet metylmalonly koenzym A-mutas eller till metylkobalamin (MeCbl). Ett fel i kobalaminmetabolismen som resulterar i minskat MeCbl och opåverkat AdoCbl är karakteristiskt för CblE-typen av homocystinuri. Detta komplement är sällsynt med autosomalt recessivt arv. Den ärftliga metioninsyntas-funktionella bristen motsvarar en defekt i det reducerande systemet som krävs för att aktivera MTR-enzymet. Symtom på detta tillstånd omfattar utvecklingsstörning, megaloblastisk anemi, homocystinuri, hypometioninemi, cerebral atrofi och hyperhomocysteinemi. Hypometioninemi förblir dock ett inkonsekvent symptom. Minskad MeCbl tillsammans med normalt kobalaminupptag tyder på minskad intracellulär metioninbiosyntes. Förekommer huvudsakligen i barndomen, 15 patogena mutationer kan associeras med homocystinuri av CblE-typ. Dessutom är vaskulära abnormiteter associerade med denna defekt. Försämrad reduktion av en oxiderad koboltatom i det aktiva stället för MTR är associerat med detta tillstånd, där enzymaktivitet kan korrigeras med reduktionsmedel. Sällsynta polymorfismer relaterade till denna sjukdom inkluderar (MTRR):c.1459G>A, (MTRR):c.1623-1624insTA och (MTRR):c.903+469T>C. Dessa mutationer, exklusive (MTRR):c.1459G>A, resulterar i ett ramskifte som producerar prematura termineringskodon. Eftersom efterföljande produkter är avlägsna från det normala uppstår mutant mRNA och nonsensmedierad sönderfall (FMN) initieras. Den stora insättningen av 903_904ins140 motsvarande 903+469T>C är mest utbredd i CblE-patologi. Aktiveringen av en förbättrad splitsare i intron 6 är ofullständig, vilket ger små mängder av normalt splitsat MTRR-mRNA. Prenatal diagnos av detta tillstånd är möjlig med [14C]-metyltetrahydrofolat. Mutationsanalys i naturliga korionvilli och [14C]-formiat i aminosyror inom dessa villi eller odlade amniocyter indikerar CblE-defekten. Dessutom är makrocytisk anemi ett typiskt kännetecken för CblE-defekten och kan korrigeras genom administrering av OH-kobalamin eller folattillskott.
Kranskärlssjukdom
Homocystein, en svavelbaserad aminosyra, är huvudprodukten av metionindemetylering. Förhöjt homocystein är en oberoende riskfaktor för hjärt-kärlsjukdom och omvänt korrelerad till konsumerat vitamin B12/B6 och folatnivåer. Homocystein-metylering till metionin katalyseras av MTR, vilket resulterar i lämpliga intracellulära nivåer av metionin och tetrahydrofolat, tillsammans med icke-toxiska homocysteinnivåer. GG-fenotypen främjar utvecklingen av prematur kranskärlssjukdom (CAD) oberoende av hyperhomocysteinemi. Hyperhomocysteinemi är associerad med cerebral, koronar och perifer aterosklerotisk patologi eftersom den främjar dysfunktion av endotelceller, vidhäftning av blodplättar och proliferation av vaskulära glatta muskelceller. DNA-skador och homocysteinnivåer är proportionella mot CAD-allvarligheten. Mikronukleusfrekvens i humana lymfocyter, beroende på homocysteinnivåer, ökar reaktiva syrearter och uracilinkorporering i DNA-metylering, vilket främjar genetiska förändringar och punktmutationer. Den (MTRR):c.66A>G, polymorfisminnehållande kromosomen är benägen att fragmenteras. Denna kromosomförlust eller globala DNA-hypometylering resulterar i underkondensering av pericentromert heterokromatin, bildning av mikrokärnor och förhöjda risker för aneuploidi. Samuttryck av denna mutation och 677T-polymorfismen i metionintetrahydrofolatreduktas (MTHFR) Metylentetrahydrofolatreduktas verkar för att främja omfattningen av DNA-skada.
Hypometylering på grund av försämrad metylering uppreglerar aterosklerotiska känsliga gener samtidigt som den nedreglerar aterosklerosskyddande gener. Denna abnormitet är närvarande under den aterosklerotiska patologin, vilket ökar transkriptionsaktiviteten hos blodplättshärledd tillväxtfaktor (PDGF) och främjar proliferation av glatta muskelceller.
Neuralrörsdefekter
Ryggmärgsbråck
MTRR kräver vitamin B12 för att upprätthålla metylsyntasreaktionen medan folat behövs för normal syntes av nukleotidprekursorer. Dessa säkerställer normal DNA-syntes och cellulära metyleringsreaktioner. Kroniska folat- eller metylbrister är därigenom kopplade till onormal DNA-metylering. 66A>G polymorfismen är uppreglerad i neuralrörsdefekter och ökar risken för ryggmärgsbråck med två gånger. Homozygos för denna mutation är en etablerad maternell riskfaktor för ryggmärgsbråck, särskilt med lågt intracellulärt vitamin B12 i cirkulationen eller fostervatten. Vitamin B12 återspeglas av plasmametylmalonsyra (MMA), en förhöjning som indikerar nedsatt B12-upptag eller metabolism. En förhöjd MMA i kombination med MTRR-mutationen motsvarar en 5-faldig ökning av ryggmärgsbråck. Verkningsmekanismen för denna polymorfism är genom modern, därför finns det ingen preferensöverföring av denna mutation från förälder till barn. Onormal MTRR-bindning till MTR-cob(I)alamin-enzymkomplexet reglerar ned hastigheten av homocysteinmetylering. Följande minskningar av metionin och S-adenosylmetionin påverkar DNA-, gen- och proteinmetylering negativt, som alla är involverade i neuralrörsförslutning. Ökad proliferation under neurulation minskar tillgängligheten av DNA-nukleotider. Eftersom dessa inte kan ersättas på grund av försämrad DNA-metylering och nukleotidbildning resulterar påföljande störd neurulation i bildandet av neuralrörsdefekter. Samuttryck av denna mutation med 677C>T MTHFR-polymorfismen främjar risken för spina bifida jämfört med en oberoende verkande 66A>G-mutation.
Downs syndrom
Trisomi 21 eller Downs syndrom är den vanligaste mänskliga kromosomavvikelsen som uppstår från onormal kromosomsegregation i meios. Tillståndet kan uppstå under anafas i meios(I), vilket markerar oocytmognad före ägglossning och/eller under anafas i meios (II), vilket betyder befruktning. Metabolisk påverkan under dessa stadier främjas av lågt vitamin B12. Metylering av homocystein till metionin påverkas, främst av (MTRR):c.66A>G polymorfism. Kronisk homocysteinhöjning ökar s-adenosyl-L-homocysteinnivåerna, vilket följaktligen hämmar metyltransferasaktivitet och främjar DNA-hypometylering. Mödrar som är homozygota för denna mutation (GG-fenotyp) löper större risk att få ett barn med downs syndrom jämfört med heterozygoter (GA-fenotyp). Geografiskt är irländska populationer mer benägna att vara homogena medan nordamerikanska populationer vanligtvis är heterogena, vilket resulterar i en större förekomst av polymorfism i den förstnämnda gruppen. Den homozygota mutanta allelen främjar DNA-hypometylering och meiotisk icke-disjunktion, vilket ökar risken för downs syndrom. Denna polymorfism korrelerar till en 2,5-faldig riskökning oberoende och en 4-faldig riskökning när den samtidigt uttrycks med 677C>T MTHFR-mutationen. Kombination med MTR2756A>G genetisk polymorfism ökar risken för downs syndrom ytterligare.
Se även
Vidare läsning
- Wilson A, Platt R, Wu Q, Leclerc D, Christensen B, Yang H, Gravel RA, Rozen R (augusti 1999). "En vanlig variant av metioninsyntasreduktas i kombination med låg kobalamin (vitamin B12) ökar risken för ryggmärgsbråck". Molekylär genetik och metabolism . 67 (4): 317–23. doi : 10.1006/mgme.1999.2879 . PMID 10444342 .
- Wilson A, Leclerc D, Rosenblatt DS, Gravel RA (oktober 1999). "Molekylär grund för metioninsyntasreduktasbrist hos patienter som tillhör cblE-komplementeringsgruppen av störningar i folat/kobalaminmetabolism" . Human molekylär genetik . 8 (11): 2009–16. doi : 10.1093/hmg/8.11.2009 . PMID 10484769 .
- James SJ, Pogribna M, Pogribny IP, Melnyk S, Hine RJ, Gibson JB, Yi P, Tafoya DL, Swenson DH, Wilson VL, Gaylor DW (oktober 1999). "Onormal folatmetabolism och mutation i metylentetrahydrofolatreduktasgenen kan vara moderns riskfaktorer för Downs syndrom. " American Journal of Clinical Nutrition . 70 (4): 495–501. doi : 10.1093/ajcn/70.4.495 . PMID 10500018 .
- Leclerc D, Odièvre M, Wu Q, Wilson A, Huizenga JJ, Rozen R, Scherer SW, Gravel RA (november 1999). "Molekylär kloning, uttryck och fysisk kartläggning av den humana metioninsyntasreduktasgenen". Gene . 240 (1): 75–88. doi : 10.1016/S0378-1119(99)00431-X . PMID 10564814 .
- Doolin MT, Barbaux S, McDonnell M, Hoess K, Whitehead AS, Mitchell LE (november 2002). "Moderns genetiska effekter, utövade av gener involverade i homocysteinremetylering, påverkar risken för ryggmärgsbråck. " American Journal of Human Genetics . 71 (5): 1222–6. doi : 10.1086/344209 . PMC 385102 . PMID 12375236 .
- Olteanu H, Munson T, Banerjee R (november 2002). "Skillnader i effektiviteten av reduktiv aktivering av metioninsyntas och exogena elektronacceptorer mellan de vanliga polymorfa varianterna av humant metioninsyntasreduktas". Biokemi . 41 (45): 13378–85. doi : 10.1021/bi020536s . PMID 12416982 .
- Zavadakova P, Fowler B, Zeman J, Suormala T, Pristoupilová K, Kozich V, Zavad'áková P (oktober 2002). "CblE-typ av homocystinuri på grund av metioninsyntasreduktasbrist: kliniska och molekylära studier och prenatal diagnos i två familjer". Journal of Inherited Metabolic Disease . 25 (6): 461–76. doi : 10.1023/A:1021299117308 . PMID 12555939 . S2CID 9114486 .
- Pietrzyk JJ, Bik-Multanowski M, Sanak M, Twardowska M (2003). "Polymorfismer av 5,10-metylentetrahydrofolat och metioninsyntasreduktasgener som oberoende riskfaktorer för ryggmärgsbråck". Journal of Applied Genetics . 44 (1): 111–3. PMID 12590188 .
- Zhu H, Wicker NJ, Shaw GM, Lammer EJ, Hendricks K, Suarez L, Canfield M, Finnell RH (mars 2003). "Homocysteinremetyleringsenzympolymorfismer och ökade risker för neuralrörsdefekter". Molekylär genetik och metabolism . 78 (3): 216–21. doi : 10.1016/S1096-7192(03)00008-8 . PMID 12649067 .
- Brilakis ES, Berger PB, Ballman KV, Rozen R (juni 2003). "Metylentetrahydrofolatreduktas (MTHFR) 677C>T och metioninsyntasreduktas (MTRR) 66A>G polymorfismer: samband med serumhomocystein och angiografisk kranskärlssjukdom i eran av mjölprodukter berikade med folsyra". Åderförkalkning . 168 (2): 315–22. doi : 10.1016/S0021-9150(03)00098-4 . PMID 12801615 .
- Sliwerska E, Szpecht-Potocka A (2003). "[Mutationer av MTHFR, MTR, MTRR gener som högriskfaktorer för neuralrörsdefekter]". Medycyna Wieku Rozwojowego . 6 (4): 371–82. PMID 12810988 .
- Beyer K, Lao JI, Latorre P, Riutort N, Matute B, Fernández-Figueras MT, Mate JL, Ariza A (juli 2003). "Metioninsyntaspolymorfism är en riskfaktor för Alzheimers sjukdom". NeuroReport . 14 (10): 1391–4. doi : 10.1097/01.wnr.0000073683.00308.0e . PMID 12876480 . S2CID 33245738 .
- Bosco P, Guéant-Rodriguez RM, Anello G, Barone C, Namour F, Caraci F, Romano A, Romano C, Guéant JL (september 2003). "Metioninsyntas (MTR) 2756 (A --> G) polymorfism, dubbel heterozygositet metioninsyntas 2756 AG/metioninsyntasreduktas (MTRR) 66 AG och förhöjd homocysteinemi är tre riskfaktorer för att få ett barn med Downs syndrom". American Journal of Medical Genetics. Del A . 121A (3): 219–24. doi : 10.1002/ajmg.a.20234 . PMID 12923861 . S2CID 38425348 .
- Olteanu H, Wolthers KR, Munro AW, Scrutton NS, Banerjee R (februari 2004). "Kinetisk och termodynamisk karakterisering av de vanliga polymorfa varianterna av humant metioninsyntasreduktas". Biokemi . 43 (7): 1988–97. doi : 10.1021/bi035910i . PMID 14967039 .
- Gemmati D, Ongaro A, Scapoli GL, Della Porta M, Tognazzo S, Serino ML, Di Bona E, Rodeghiero F, Gilli G, Reverberi R, Caruso A, Pasello M, Pellati A, De Mattei M (maj 2004). "Vanliga genpolymorfismer i den metaboliska folat- och metyleringsvägen och risken för akut lymfoblastisk leukemi och non-Hodgkins lymfom hos vuxna. " Cancerepidemiologi, biomarkörer och förebyggande . 13 (5): 787–94. doi : 10.1158/1055-9965.787.13.5 . PMID 15159311 . S2CID 14936869 .
- Leal NA, Olteanu H, Banerjee R, Bobik TA (november 2004). "Humant ATP:Cob(I)alamin adenosyltransferas och dess interaktion med metioninsyntasreduktas" . Journal of Biological Chemistry . 279 (46): 47536–42. doi : 10.1074/jbc.M405449200 . PMID 15347655 .
- Vaughn JD, Bailey LB, Shelnutt KP, Dunwoody KM, Maneval DR, Davis SR, Quinlivan EP, Gregory JF, Theriaque DW, Kauwell GP (november 2004). "Metioninsyntasreduktas 66A->G polymorfism är associerad med ökad plasmakoncentration av homocystein i kombination med den homozygota metylentetrahydrofolatreduktas 677C->T-varianten" . Journal of Nutrition . 134 (11): 2985–90. doi : 10.1093/jn/134.11.2985 . PMID 15514263 .





