|
| COQ5- |
|---|
| identifierare |
|---|
|
, koenzym Q5, metyltransferas, COQ10D9 |
| Externa ID:n |
|
|
|
|
|
|
| Wikidata |
|
Koenzym Q5, metyltransferas , mer känt som COQ5 , är ett enzym som är involverat i elektrontransportkedjan . COQ5 är beläget i mitokondriella matrisen och är en del av biosyntesen av ubikinon .
Fungera
COQ5 har rollen som katalysator i C-metyleringen i coenzym Q- biosyntesen, på bensoeringen av CoQ6, den biosyntetiska mellanprodukten, i både människor och jäst Saccharomyces cerevisiae . COQ5 är en av de elva polypeptiderna i jäst, som är nödvändiga för Q-produktion. Dessutom monteras den med CoQ-synthome, ett komplex med flera underenheter. Hos människor uppstår primär Q-brist på grund av att många COQ-gener muterar. Och sjukdomar som mitokondriella, kardiovaskulära, njursjukdomar och neurodegenerativa sjukdomar är resultat av minskningen av Q-biosyntesen. Utveckling av lösliga COQ5-proteiner kan appliceras på andra mitokondriella proteiner. Koenzym Q10-brist är associerad med COQ5. Därför, för att upprätthålla CoQ10-nivåer i mänskliga celler, krävs COQ5.
Katalytisk aktivitet
Katalyserar C-metylering och biosyntetisk process för ubikinon .
Mekanism
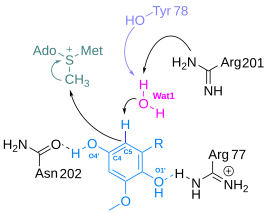
COQ5 är ett S-adenosylmetionin (SAM)-beroende metyltransferas (SAM-MTase) som katalyserar C-metyleringssteget och omvandlar 2-metoxi-6-polyprenyl-1,4-bensokinon (DDMQH 2 ) till 2-metoxi-5- metyl-6-polyprenyl-1,4-bensokinon (DMQH 2 ) i CoQ6-biosyntesvägen.

I den katalytiska mekanismen för COQ5, baserat på de strukturella analyserna, som det första steget, före metylöverföring, abstraherar Arg201 ett väte från vattenmolekylen och bildar en negativt laddad syreatom som deprotonerar C5-atomen i DDMQH2. Om man tittar på DDMQH2-substratet och Asn202, bildar hydroxylgruppen på C4-atomen och sidokedjan en vätebindning som leder till bildandet av O4'-anjonen. C5-anjonens stabilitet är ett resultat av att den negativa laddningen delokaliseras på π-bindningskonjugationssystemet. Tyr78 fungerar som en katalytisk bas och Tyr78, Arg201 och Asn202 är invarianta i COQ5-homologer.