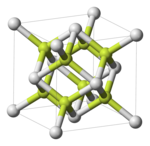
Interchalcogen
Kalkogenerna reagerar med varandra och bildar interkalkogenföreningar .
Även om inget kalkogen är extremt elektropositivt och inte heller lika elektronegativt som halogenfluoret (det mest elektronegativa elementet), finns det en stor skillnad i elektronegativitet mellan toppen ( syre = 3,44 - det näst mest elektronegativa elementet efter fluor) och botten ( polonium = 2.0) i gruppen. I kombination med det faktum att det finns en betydande trend mot att öka metallbeteendet medan det går nedåt i gruppen (syre är en gasformig icke-metall , medan polonium är en silverfärgad post-transition metall ), gör detta att interkalkogener uppvisar många olika typer av bindning: kovalent , joniska , metalliska och semimetalliska .
Kända binära interkalkogener
| O | |||||
|---|---|---|---|---|---|
| O |
S
|
||||
| S |
Se
|
||||
| Se | Kön x S y
|
Te
|
|||
| Te | Te x S y (många okända) |
Te x Se y (många okända) |
Po
|
||
| Po |
PoS (många okända) |
Po x Se y
(många okända) |
Po x Te y
(okänd) |
Bindning i binära interkalkogener
Om man går ner i tabellen ovan, finns det en övergång från kovalent bindning (med diskreta molekyler ) till jonbindning ; över bordet sker en övergång från jonbindning till metallisk bindning . (Kovalent bindning uppstår när båda elementen har liknande höga elektronegativiteter; jonbindning uppstår när de två elementen har mycket olika elektronegativitet, den ena låg och den andra hög; metallisk bindning uppstår när båda elementen har liknande låg elektronegativitet.) Till exempel i kolumnen längst till vänster. i tabellen (med bindningar till syre), O 2 och O 3 är rent kovalenta, SO 2 och SO 3 är polära molekyler, SeO 2 bildar kedjade polymerer (sträcker sig i en dimension), TeO 2 bildar skiktade polymerer (sträcker sig i två dimensioner) ), och PoO2 är jonisk med fluoritstrukturen (spatiala polymerer, sträcker sig i tre dimensioner); i tabellens nedre rad (med bindningar till polonium) är PoO 2 och PoS joniska, Po x Se y och Po x Te y är semimetalliska och Po ∞ är metalliska.
Sammanfattning av kända binära interkalkogener
Svavelkalkogenider

-
Lägre svaveloxider , S x O y där förhållandet X:Y är större än 1:2
- Disulfurmonoxid , S 2 O
- Disulfid , S 2 O 2
- Svavelmonoxid , SO
- Svaveldioxid , SO 2
- Svaveltrioxid , SO 3
- Högre svaveloxider , SO x där x>3
Selenkalkogenider

- Selendioxid , SeO 2
- Selentrioxid , SeO 3
- Många "legeringar" av selen och svavel i olika koncentrationer med semimetallisk bindning, Sex S y
- " Seleniummonosulfid ", SeS
- " Seleniumdisulfid ", SeS 2 , faktiskt en 2:1 blandning av cyklo-Se 3 S 5 och cyklo-Se 2 S 6
- " Selentrisulfid ", SeS 3 , som faktiskt förekommer som den cykliska dimeren Se 2 S 6
Tellurium chalkogenides
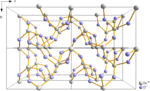
- Tellurmonoxid , TeO (instabil transient art)
- Tellurdioxid , TeO 2
- Tellurtrioxid , TeO3
- Ditelluriumpentoxid, Te 2 O 5
- Många "legeringar" av tellur och svavel i olika koncentrationer med semimetallisk bindning, Te x S y
- Många "legeringar" av tellur och selen i olika koncentrationer med semimetallisk bindning, Te x Se y
Polonium chalcogenides
- Poloniummonoxid , PoO
- Poloniumdioxid , PoO 2
- Poloniumtrioxid , PoO 3
- Poloniummonosulfid, PoS
- Många "legeringar" av polonium och selen i olika koncentrationer med semimetallisk bindning, Po x Se y
- Många "legeringar" av polonium och tellur i olika koncentrationer med semimetallisk bindning, Po x Te y