Histidin-fosfoöverföringsdomän
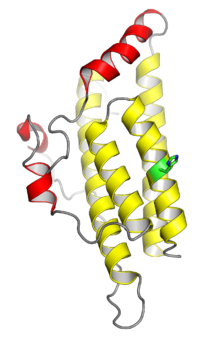
- Kristallstrukturen för jästhistidinfosfotransferasproteinet Ypd1. De fyra helixarna som visas i gult omfattar det konserverade fyrhelixknippet som är typiskt för monomera HPt-domäner; spiralerna som visas i rött är insättningar som är specifika för Ypd1. Histidin-fosforyleringsstället visas i grönt. Från .
| |||||||||
| fosfotransferdomän | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifierare | |||||||||
| Symbol | Hpt | ||||||||
| Pfam | PF01627 | ||||||||
| InterPro | IPR008207 | ||||||||
| SMART | HPT | ||||||||
| PROSITE | PS50894 | ||||||||
| |||||||||
| Histidin-fosfotransferas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Kristallstrukturen av Caulobacter crescentus histidin-fosfotransferasproteinet ChpT i dimer form. De fyra helixarna som visas i gult omfattar det konserverade fyra-helixknippet, med histidin-fosforyleringsställena markerade i grönt. De domäner som visas i rött och brun är pseudo-CA-domäner som liknar de ATP-bindande domänerna av histidinkinaser, men som inte binder eller hydrolyserar ATP. Från .
| |||||||||
| Identifierare | |||||||||
| Symbol | HPTransfase | ||||||||
| Pfam | PF10090 | ||||||||
| InterPro | IPR018762 | ||||||||
| |||||||||
Histidin-fosfotransferdomäner och histidin-fosfotransferaser (båda ofta förkortade HPt ) är proteindomäner involverade i "fosforrelä"-formen av tvåkomponents regulatoriska system . Dessa proteiner har en fosforylerbar histidinrest och är ansvariga för överföring av en fosforylgrupp från en aspartatrest på en mellanliggande "mottagar" -domän , vanligtvis en del av ett hybridhistidinkinas, till ett aspartat på en slutlig responsregulator .
Fungera
Vid ortodox tvåkomponentsignalering autofosforylerar ett histidinkinasprotein på en histidinrest som svar på en extracellulär signal, och fosforylgruppen överförs därefter till en aspartatrest på mottagardomänen av en svarsregulator . I fosforlayer innehåller "hybrid" histidinkinas en intern aspartat-innehållande mottagardomän till vilken fosforylgruppen överförs, varefter ett HPt-protein innehållande en fosforylerbar histidin tar emot fosforylgruppen och slutligen överför den till responsregulatorn. Reläsystemet fortskrider alltså i ordningen His-Asp-His-Asp, med den andra His bidragit med Hpt. I vissa fall är ett fosforreläsystem konstruerat av fyra separata proteiner snarare än ett hybridhistidinkinas med en intern mottagardomän, och i andra exempel finns både mottagar- och HPt-domänerna i histidinkinaspolypeptidkedjan. En folkräkning av tvåkomponentsystemdomänarkitektur fann att HPt-domäner i bakterier är vanligare som domäner av större proteiner än de är som individuella proteiner.
förordning
Den ökade komplexiteten hos fosforlässystemet jämfört med ortodox tvåkomponentssignalering ger ytterligare möjligheter till reglering och förbättrar specificiteten hos svaret. Även om det finns mycket lite överhörning mellan ortodoxa tvåkomponentsystem tillåter fosforreläer mer komplexa signalvägar; exempel inkluderar en bifurkerad väg med flera nedströms utgångar, som i fallet med Caulobacter crescentus ChpT HPt involverad i cellcykelreglering , eller alternativt vägar där mer än ett histidinkinas kontrollerar en enda responsregulator, såsom sporuleringsvägen i Bacillus subtilis , som kan ge upphov till komplexa tidsvariationer. I vissa kända fall finns det ytterligare en form av reglering i fosfohistidinfosfatasenzymer som verkar på HPt, såsom Escherichia coli -proteinet SixA som riktar sig mot ArcB.
Strukturera

Histidin-fosfoöverföringsfunktionen kan utföras av proteiner med minst två olika arkitekturer, båda sammansatta av ett fyrhelixknippe men skiljer sig åt i sättet bunten är sammansatt. De flesta strukturellt karakteriserade HPt-proteiner, såsom Hpt-domänen från Escherichia coli -proteinet ArcB och Saccharomyces cerevisiae -proteinet Ypd1, bildar bunten som monomerer. I den mindre vanliga typen, såsom Bacillus subtilis sporulationsfaktor Spo0B eller Caulobacter crescentus -proteinet ChpT, är bunten sammansatt som en proteindimer , med likhet med strukturen hos histidinkinaser. Monomera HPt-domäner har endast en fosforylerbar histidinrest och interagerar med en responsregulator, medan dimerer har två fosforyleringsställen och kan interagera med två responsregulatorer samtidigt. Monomera HPt-domäner har ingen egen enzymatisk aktivitet och fungerar rent som fosfatskyttlar, medan den dimera Spo0B är katalytisk; dess fosfoöverföringshastighet till recipientresponsregulatorn är dramatiskt accelererad jämfört med histidinfosfat. Trots att de har en andra domän med viss likhet med ATPas- domäner har dimera HPt-proteiner inte visats binda eller hydrolysera ATP och sakna nyckelrester som finns i andra ATPaser.
De monomera och dimera formerna har inte detekterbar sekvenslikhet och är troligen inte evolutionärt relaterade; de är istället exempel på konvergent evolution . Även om dimera HPts troligen härrör från degenererade histidinkinaser, är det möjligt att monomera HPts har ett antal distinkta ursprung, eftersom det finns få evolutionära begränsningar på strukturen.
Distribution
Hos bakterier , där tvåkomponentsignalering är extremt vanlig, är cirka 25 % av kända histidinkinaser av hybridtyp. Tvåkomponentsystem är mycket sällsyntare i archaea och eukaryotes och förekommer i lägre eukaryotes och i växter men inte i metazoans . Bland kända exempel är de flesta om inte alla eukaryota tvåkomponentsystem hybridkinasfosforeläer.
En bioinformatisk folkräkning av bakteriegenom fann stora variationer i antalet (monomera) HPt-domäner som identifierats i olika bakteriefylor, med vissa genom som inte kodar för några HPts alls. I förhållande till antalet histidinkinas och responsregulatorer som finns i ett genom, har eukaryoter fler identifierbara HPt-domäner än bakterier. I svampar varierar det genomiska inventeringen av HPt-proteiner, med trådsvampar som i allmänhet har fler HPt-proteiner än jästsvampar ; endast en är kodad i det välkarakteriserade Saccharomyces cerevisiae -genomet. Växter har i allmänhet mer än en HPt, men färre HPts än responsregulatorer.