Glutamatreceptor-interagerande protein
Glutamatreceptorinteragerande protein (GRIP) hänvisar till antingen en familj av proteiner som binder till glutamatreceptorn eller specifikt till GRIP1 -proteinet inom denna familj. Proteiner i den glutamatreceptorinteragerande proteinfamiljen (GRIP) har visats interagera med GluR2 , en vanlig subenhet i AMPA-receptorn . Denna subenhet interagerar också med andra proteiner såsom protein som interagerar med C-kinas1 ( PICK1 ) och N-etylmaleimidkänsligt fusionsprotein ( NSF ). Studier har börjat belysa dess funktion; men mycket återstår fortfarande att lära om dessa proteiner.
Upptäckten och historien om GRIP 1
Upptäckten av det interagerande proteinet för glutamatreceptorn (GRIP-1) kom som ett resultat av observationen att glutamatreceptorer, såsom NMDA- receptorn , samlas vid synapser. Kort efter denna observation identifierade forskare en region på den C-terminala regionen av NMDA-receptorer som kallas tSXV-motivet som har förmågan att binda till PDZ-domänen av PSD-95- proteinet.
Forskning om NMDA-receptorlokalisering banade väg för forskning om icke-NMDA-receptorer såsom AMPA-receptorer. I likhet med NMDA-receptorer upptäcktes det att AMPA-receptorer lokaliseras i den synaptiska terminalen av neuroner i det centrala nervsystemet . Genom att använda GFP-antikroppar ( grönt fluorescerande protein ) som motsvarar GRIP-proteinet kunde forskarna använda fluorescens för att bestämma platsen för GRIP i hippocampus neuroner. En annan GFP-antikropp användes sedan för att märka GluR2-subenheten av AMPA-receptorer. Genom att använda immuncytokemi och jämföra placeringen av GRIP- och AMPA-receptorer fastställdes det att GRIP- och AMPA-receptorer upplever kolokalisering i hippocampus neuroner. Dessa fynd bekräftade den initiala hypotesen att GRIP-proteinet spelar en viktig roll för att binda AMPA-receptorer till excitatoriska synapser.
Strukturen hos GRIP innehåller sju PDZ-domäner och binder till C-terminalen av GluR2-subenheten av AMPA-receptorer. Även om antalet PDZ-domäner är olika för proteinerna PSD-95 och GRIP, är PDZ-domänen ett vanligt strukturellt motiv i proteiner som hjälper till att förmedla protein-proteininteraktioner. AMPA-receptorns aminosyrasekvens som GRIP-proteinet binder till är ESVKI. Den konserverade serinaminosyran i C-terminalen av både AMPA- och NMDA-receptorer antyder att den spelar en viktig roll för att underlätta interaktionen för GRIP och PSD-95.
GRIPs roll i AMPAR-cykling
AMPA-receptorer transporteras ständigt mellan cellmembranet och det intracellulära utrymmet och man trodde ursprungligen att GRIP kan vara ansvarig för klustringen av AMPA-receptorer vid den excitatoriska synapsen. Även om det fortfarande är oklart den exakta rollen för GRIP i denna trafficking, verkar det som att PICK1 är mer direkt ansvarig för klustringen av AMPA-receptorer på ytan och att GRIP är involverad i stabiliseringen av AMPA-receptorer intracellulärt. En studie visade att när interaktionen mellan GluR2 och GRIP störs, finns det inga förändringar i ytuttrycket av AMPA-receptorer eller den konstitutiva internaliseringen av AMPA-receptorer. Det finns emellertid en minskad mängd receptorer som förblir internaliserade när receptorcykling modifieras genom applicering av AMPA-1. Förhållandet återgår till det normala när konstitutiv återvinning tillåts ske, vilket tyder på att stabiliseringen av intracellulära receptorer är kritisk endast under AMPA-inducerad internalisering.
I senare studier visade sig två proteiner, GRIP-1 (ofta reducerat till GRIP) och ABP-L (även kallat GRIP-2 ), uttryckas av två separata gener och deras respektive bidrag till AMPA-receptorns cykling har sedan dess studerats väl. . Vart och ett av dessa proteiner har olika isoformer på grund av differentiell RNA-splitsning . Isoformerna av GRIP-1 benämns GRIP-1a och GRIP-1b medan de för ABP-L särskiljs som ABP-L och pABP-L. Den uppenbara skillnaden i båda fallen är att en isoform (GRIP1b respektive pABP-L) kan konjugeras med palmitinsyra , en verkan som kallas palmitoylering .
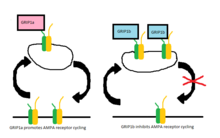
Medan GRIP från början ansågs vara involverad i stabiliseringen av AMPA-receptorer antingen på cellytan eller intracellulärt när internalisering utlöstes av AMPA-stimulering, verkar det nu som att GRIP-1-isoformerna är olika involverade i stabiliseringen av AMPA-receptorer efter att ha internaliserats på grund av NMDA- stimulering. GRIP-1a har visat sig minska de förväntade intracellulära nivåerna av AMPA-receptorer efter NMDA-stimulering. Omvänt ökar GRIP-1b intracellulära nivåer av AMPA-receptorer under samma förhållanden.
ABP-L, liksom GRIP-1b, associerar med intracellulära förråd av AMPA-receptorer. pABP-L associerar emellertid med AMPA-receptorer som ytmembranet. Det har ännu inte visats under vilka förhållanden dessa interaktioner är signifikanta i cyklingen av AMPAR.
GRIP1:s roll i Frasers syndrom
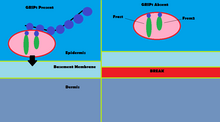
Mutationer till GRIP1 spelar en roll i mindre än 10 % av de bekräftade fallen av den grupp av medfödda defekter som kallas Frasers syndrom . Med hjälp av immunfluorescens har det visat sig att GRIP1 finns i flera typer av embryonala vävnader, inklusive mag-tarmkanalen, urinledarens knoppar, hud och mun- och näshålor. GRIP1 är också väsentligt för korrekt funktion och struktur hos den dermo-epidermala korsningen. I musmodeller leder utslag av GRIP1-protein till flera deformiteter som börjar i embryot. Dessa missbildningar inkluderar subepidermal hemorragisk blåsbildning, renal agenesis , syndaktylism , polydactylism och cryptopthalmos. En studie har visat att fullständig knock-out av GRIP1 leder till frånvaro av njurar. En annan studie visar blåsbildning av embryonal vävnad som GRIP1 uttrycks i dag 12 av embryonal liv hos möss.
Mekanismen för GRIP1 vid Frasers syndrom återfinns i interaktionen GRIP1 har med proteinerna Fras1 och Frem2. Fras1 och Frem2 är extracellulära membranproteiner nödvändiga för korrekt basalmembranfunktion såväl som morfogenes . GRIP1 spelar en viktig roll för att lokalisera Fras1 till den basala ytan av epidermala celler samt lokalisera Frem2. Att slå ut GRIP1-proteinet eller mutera det leder till dåligt uttryck av Fras1 och Frem2. GRIP1 binder specifikt till Fras1 genom ett PDZ-motiv som finns på Fras1. Frem2 har också en PDZ-domän , även om interaktionen mellan GRIP1 och Frem2 är oklar. I ett fall av Frasers syndrom saknade GRIP1 PDZ-domänerna 6 och 7. Endast de fyra första PDZ-domänerna av de sju PDZ-domänerna som GRIP1 har krävs för bindning med Fras1, vilket indikerar ytterligare mekanismer och proteiner som GRIP1 interagerar med som kan leda till Frasers syndrom när muterade. Andra mutationer i GRIP1 som leder till Frasers syndrom inkluderar nonsensmutationer, ramskiftningsmutationer, splitsningsställemutationer, en genomdeletion och en deletion av exon 18 av GRIP1-genen.
Rollen för GRIP1 i neuronmorfologi och lasttransport
Neuronmorfologi , utveckling och underhåll är beroende av uttrycket av GRIP1 i cellen. Det är mycket viktigt i den initiala utvecklingen eftersom knock-out-experiment i murina modeller resulterar i hudblåsor och embryonal dödlighet. I utvecklade murina modeller kan inaktiverande mutationer som transfekton eller dominant negativ i GRIP1 orsaka upp till 75% förlust av "primära, sekundära och högre ordningens" dendriter i utvecklande neuroner. Att inaktivera GRIP1 i levande friska neuroner i en maträtt kommer att orsaka en minskning med 20 % i den tjockaste delen av neuronen och upp till 70 % minskning i grenarna.
Defekter i neuronmorfologi på grund av GRIP1-fel kan reserveras. Ett sätt är att överuttrycka GRIP1. Detta leder till ökad, men inte fullständig återhämtning av förgrening. Ett annat protein, EphB2 , som interagerar med GRIP1, kan muteras så att en 70-90% återhämtning av förgrening är möjlig. Överuttryck av vildtypen leder emellertid till en minskning av antalet neuroner.
Motorproteiner som Kinesin (KIF5) är bundna till adaptermolekyler som GRIP1 för att flytta last från Golgi till extremiteterna av en neuroncell. GRIP1 och KIF5 är mycket vanligt förekommande tillsammans på grund av en god bindningsaffinitet (Kd varierar från 10-20nM). När det gäller hur last kommer till rätt plats har det funnits en hypotes som kallas den "smarta motorn". Man tror för närvarande att den "smarta motorn" känner igen skillnaden mellan axonala (belagda med KLC-protein) och dendritiska (belagda med KHC) proteiner. Destinationen väljs därefter. Tyvärr är detaljer om de mellanliggande transportstegen okända. Men vid destinationen stör bindningen av protein 14-3-3 interaktionen mellan KIF5 och GRIP1. Detta frigör lasten.