Genetik av åldrande
Genetik av åldrande är i allmänhet oroad över livsförlängning i samband med genetiska förändringar, snarare än med accelererade åldrande sjukdomar som leder till minskad livslängd.
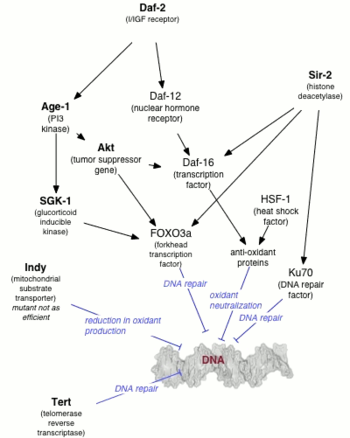
Den första mutationen som visade sig öka livslängden hos ett djur var ålder-1- genen i Caenorhabditis elegans . Michael Klass upptäckte att livslängden för C. elegans kunde förändras av mutationer, men Klass trodde att effekten berodde på minskad matkonsumtion ( kaloribegränsning) . Thomas Johnson visade senare att livsförlängning på upp till 65 % berodde på själva mutationen snarare än på kalorirestriktion, och han döpte genen till age-1 i förväntan att andra gener som kontrollerar åldrandet skulle hittas. Ålder -1 -genen kodar för den katalytiska subenheten av klass-I fosfatidylinositol 3-kinas (PI3K).
Ett decennium efter Johnsons upptäckt visade Cynthia Kenyon att daf-2 , en av de två gener som är väsentliga för dauerlarverbildning, fördubblar C. elegans livslängd. Kenyon visade att daf-2- mutanterna, som skulle bilda dauers över 25 °C (298 K; 77 °F) skulle kringgå dauertillståndet under 20 °C (293 K; 68 °F) med en fördubbling av livslängden. Före Kenyons studie trodde man allmänt att livslängden bara kunde ökas till priset av en förlust av reproduktionsförmåga, men Kenyons nematoder bibehöll ungdomlig reproduktionsförmåga och förlängde ungdomen i allmänhet. Efterföljande genetisk modifiering (PI3K-nollmutation) till C. elegans visade sig förlänga maximal livslängd tio gånger.
Långlivade mutanter av C. elegans ( ålder-1 och daf-2 ) visades vara resistenta mot oxidativ stress och UV-ljus . Dessa långlivade mutanter hade en högre DNA-reparationsförmåga än vildtyp C. elegans . Nedbrytning av nukleotidexcisionsreparationsgenen Xpa-1 ökade känsligheten för UV och minskade livslängden för de långlivade mutanterna. Dessa fynd stöder hypotesen att DNA-skador har en betydande roll i åldrandeprocessen .
Genetiska modifieringar hos andra arter har inte uppnått en så stor livslängdsförlängning som har setts för C. elegans . Drosophila melanogasters livslängd har fördubblats. Genetiska mutationer hos möss kan öka den maximala livslängden till 1,5 gånger det normala och upp till 1,7 gånger det normala i kombination med kalorirestriktion .
I jäst krävs NAD +-beroende histondeacetylas Sir2 för genomisk tystnad vid tre loci: jästparningsställena , telomererna och ribosomalt DNA ( rDNA). I vissa arter av jäst kan replikativt åldrande delvis orsakas av homolog rekombination mellan rDNA-upprepningar; excision av rDNA-upprepningar resulterar i bildandet av extrakromosomala rDNA-cirklar (ERC). Dessa ERC replikerar och segregerar företrädesvis till modercellen under celldelning och tros resultera i cellulär åldrande genom att titrera bort (tävlar om) väsentliga nukleära faktorer . ERC har inte observerats hos andra arter (inte ens alla stammar av samma jästart) av jäst (som också uppvisar replikativ senescens), och ERC tros inte bidra till åldrande hos högre organismer som människor (de har inte visats ackumuleras i däggdjur på liknande sätt som jäst). Extrakromosomalt cirkulärt DNA (eccDNA) har hittats i maskar, flugor och människor. Ursprunget och rollen för eccDNA vid åldrande, om någon, är okänd.
Trots avsaknaden av ett samband mellan cirkulärt DNA och åldrande i högre organismer, kan extra kopior av Sir2 förlänga livslängden för både maskar och flugor (även om detta fynd hos flugor inte har replikerats av andra utredare, och aktivatorn av Sir2 resveratrol ökar inte livslängden reproducerbart hos någon av arterna.) Huruvida Sir2-homologerna i högre organismer har någon roll i livslängden är oklart, men det mänskliga SIRT1-proteinet har visat sig deacetylera p53 , Ku70 och gaffelhuvudfamiljen av transkriptionsfaktorer . SIRT1 kan också reglera acetylater som CBP/p300 och har visat sig deacetylera specifika histonrester .
RAS1 och RAS2 påverkar också åldrande i jäst och har en human homolog. RAS2-överuttryck har visat sig förlänga livslängden i jäst.
Andra gener reglerar åldrandet i jäst genom att öka motståndet mot oxidativ stress . Superoxiddismutas , ett protein som skyddar mot effekterna av mitokondriella fria radikaler , kan förlänga jästens livslängd i stationär fas när det överuttrycks.
Hos högre organismer kommer åldrandet sannolikt delvis att regleras genom insulin/IGF-1-vägen. Mutationer som påverkar insulinliknande signalering i maskar, flugor och tillväxthormon/IGF1-axeln hos möss är associerade med förlängd livslängd. I jäst regleras Sir2-aktiviteten av nikotinamidaset PNC1. PNC1 är transkriptionellt uppreglerad under stressiga förhållanden som kalorirestriktion , värmechock och osmotisk chock . Genom att omvandla nikotinamid till niacin avlägsnas nikotinamid, vilket hämmar aktiviteten hos Sir2. Ett nikotinamidas som finns hos människor, känt som PBEF, kan ha en liknande funktion, och en utsöndrad form av PBEF som kallas visfatin kan hjälpa till att reglera insulinnivåerna i serum . Det är dock inte känt om dessa mekanismer även finns hos människor, eftersom det finns uppenbara skillnader i biologi mellan människor och modellorganismer.
Sir2-aktiviteten har visat sig öka under kalorirestriktioner. På grund av bristen på tillgängligt glukos i cellerna finns mer NAD+ tillgängligt och kan aktivera Sir2. Resveratrol , en stilbenoid som finns i skalet på röda druvor , rapporterades förlänga livslängden för jäst, maskar och flugor (livslängden hos flugor och maskar har visat sig vara irreproducerbar av oberoende utredare). Det har visat sig aktivera Sir2 och efterliknar därför effekterna av kalorirestriktion, om man accepterar att kalorirestriktion verkligen är beroende av Sir2.
Enligt GenAge-databasen över åldringsrelaterade gener finns det över 1800 gener som förändrar livslängden i modellorganismer : 838 i jordspolmasken ( Caenorhabditis elegans ), 883 i bagerijästen ( Saccharomyces cerevisiae ), 170 i fruktflugan ( Drosophila ) melanogaster ) och 126 hos musen ( Mus musculus ).
Följande är en lista över gener kopplade till livslängd genom forskning på modellorganismer :
| Podospora | Saccharomyces | Caenorhabditis | Drosophila | Mus |
|---|---|---|---|---|
| grisea | LAG1 | daf-2 | sod1 | Prop-1 |
| LAC1 | ålder-1 /daf-23 | kat1 | p66shc (Inte oberoende verifierad) | |
| grop-1 | Ghr | |||
| RAS1 | daf-18 | månad | mclk1 | |
| RAS2 | akt-1/akt-2 | |||
| PHB1 | daf-16 | |||
| PHB2 | daf-12 | |||
| CDC7 | ctl-1 | |||
| BUD1 | gammal-1 | |||
| RTG2 | spe-26 | |||
| RPD3 | clk-1 | |||
| HDA1 | mev-1 | |||
| SIR2 | ||||
| aak-2 | ||||
| SIR4-42 | ||||
| UTH4 | ||||
| YGL023 | ||||
| SGS1 | ||||
| RAD52 | ||||
| FOB1 |
I juli 2020 identifierade forskare, med hjälp av offentliga biologiska data om 1,75 miljoner människor med känd livslängd totalt sett, 10 genomiska loci som tycks ha en inneboende påverkan på hälsa , livslängd och livslängd – varav hälften inte har rapporterats tidigare med betydelse för hela genomet och de flesta är associerade med hjärt-kärlsjukdom – och identifiera hemmetabolism som en lovande kandidat för vidare forskning inom området. Deras studie tyder på att höga nivåer av järn i blodet sannolikt minskar, och gener som är involverade i metaboliseringen av järn sannolikt ökar friska levnadsår hos människor.
Ned Sharpless och medarbetare visade den första in vivo-kopplingen mellan p16-uttryck och livslängd. De fann minskat p16-uttryck i vissa vävnader hos möss med mutationer som förlänger livslängden, såväl som i möss som fick sin livslängd förlängd genom matrestriktioner. Jan van Deursen och Darren Baker i samarbete med Andre Terzic vid Mayo Clinic i Rochester, Minn., gav det första in vivo-beviset för ett orsakssamband mellan cellulär åldrande och åldrande genom att förhindra ackumulering av åldrande celler i BubR1 progeroidmöss. I frånvaro av åldrande celler visade mössens vävnader en stor förbättring av den vanliga bördan av åldersrelaterade störningar. De utvecklade inte grå starr , undvek den vanliga muskelförlusten med åldern. De behöll fettlagren i huden som vanligtvis tunnas ut med åldern och, hos människor, orsakar rynkor. En andra studie ledd av Jan van Deursen i samarbete med ett team av medarbetare vid Mayo Clinic och Groningen University, gav det första direkta in vivo beviset på att cellulär åldrande orsakar tecken på åldrande genom att eliminera åldrande celler från progeroidmöss genom att introducera en läkemedelsinducerbar självmordsgenen och sedan behandla mössen med drogen för att döda åldrande celler selektivt, i motsats till att minska p16 i hela kroppen. En annan Mayo-studie ledd av James Kirkland i samarbete med Scripps och andra grupper visade att senolytika, läkemedel som riktar sig mot åldrande celler, förbättrar hjärtfunktionen och förbättrar vaskulär reaktivitet hos gamla möss, lindrar gångstörningar orsakade av strålning hos möss och fördröjer skörhet, neurologisk dysfunktion. och osteoporos hos progeroidmöss. Upptäckten av senolytiska läkemedel baserades på ett hypotesdrivet tillvägagångssätt: utredarna utnyttjade observationen att åldrande celler är resistenta mot apoptos för att upptäcka att pro-överlevnadsvägar är uppreglerade i dessa celler. De visade att dessa överlevnadsvägar är "akilleshäl" för åldrande celler med hjälp av RNA-interferensmetoder, inklusive Bcl-2-, AKT-, p21- och tyrosinkinasrelaterade vägar. De använde sedan läkemedel som var kända för att rikta in sig på de identifierade vägarna och visade att dessa läkemedel dödar åldrande celler genom apoptos i kultur och minskar åldrande cellbörda i flera vävnader in vivo. Viktigt är att dessa läkemedel hade långtidseffekter efter en engångsdos, i överensstämmelse med avlägsnande av åldrande celler, snarare än en tillfällig effekt som kräver fortsatt närvaro av läkemedlen. Detta var den första studien som visade att rensa åldrande celler förbättrar funktionen hos möss i kronologisk ålder.
Se även
externa länkar
- Human Aging Genomic Resources , en samling databaser och verktyg utformade för att hjälpa forskare att studera genetiken för mänskligt åldrande
- NetAge Database , en onlinedatabas och nätverksanalysverktyg för biogerontologisk forskning