Digital mikrofluidik
Digital microfluidics (DMF) är en plattform för lab-on-a-chip-system som är baserad på manipulering av mikrodroppar. Droppar dispenseras, flyttas, lagras, blandas, reageras eller analyseras på en plattform med en uppsättning isolerade elektroder. Digital mikrofluidik kan användas tillsammans med analytiska analysprocedurer såsom masspektrometri, kolorimetri, elektrokemisk och elektrokemiluminescens.
Översikt
I analogi med digital mikroelektronik kan digitala mikrofluidoperationer kombineras och återanvändas inom hierarkiska designstrukturer så att komplexa procedurer (t.ex. kemisk syntes eller biologiska analyser ) kan byggas upp steg för steg. Och i motsats till mikrofluidik med kontinuerligt flöde fungerar digital mikrofluidik ungefär på samma sätt som traditionella bänkprotokoll, bara med mycket mindre volymer och mycket högre automatisering. Således kan ett brett utbud av etablerade kemiska procedurer och protokoll sömlöst överföras till ett nanoliter droppformat. Elektrovätning , dielektrofores och oblandbara vätskeflöden är de tre vanligaste principerna som har använts för att generera och manipulera mikrodroppar i en digital mikrofluidisk enhet.
En digital mikrofluidisk (DMF) enhetsuppställning beror på de använda substraten, elektroderna, konfigurationen av dessa elektroder, användningen av ett dielektriskt material, tjockleken på det dielektriska materialet, de hydrofoba skikten och den applicerade spänningen.
Ett vanligt substrat som används är denna typ av system är glas. Beroende på om systemet är öppet eller stängt skulle det finnas antingen ett eller två lager glas. Det undre lagret av enheten innehåller en mönstrad grupp av individuellt styrbara elektroder. När man tittar på ett slutet system, finns det vanligtvis en kontinuerlig jordelektrod som hittas genom det översta lagret, vanligtvis gjord av indiumtennoxid ( ITO ). Det dielektriska lagret finns runt elektroderna i enhetens undre lager och är viktigt för att bygga upp laddningar och elektriska fältgradienter på enheten. Ett hydrofobt skikt appliceras på systemets översta skikt för att minska ytenergin där droppen faktiskt kommer att vara i kontakt med. Den applicerade spänningen aktiverar elektroderna och tillåter förändringar i vätbarheten av droppar på enhetens yta. För att flytta en droppe läggs en styrspänning på en elektrod intill droppen och samtidigt avaktiveras elektroden strax under droppen. Genom att variera den elektriska potentialen längs en linjär uppsättning av elektroder, kan elektrovätning användas för att flytta droppar längs denna linje av elektroder.
Modifieringar av denna grund kan också tillverkas i den grundläggande designstrukturen. Ett exempel på detta är tillsatsen av elektrokemiluminescensdetektorer i indiumtennoxidskiktet (jordelektroden i ett slutet system) som hjälper till att detektera luminoforer i droppar. I allmänhet kan olika material också användas för att ersätta grundläggande komponenter i ett DMF-system, såsom användningen av PDMS istället för glas för substratet. Flytande material kan tillsättas, såsom olja eller annat ämne, till ett slutet system för att förhindra avdunstning av material och minska ytkontamination. DMF-system kan också vara kompatibla med joniska vätskedroppar med användning av en olja i en sluten anordning eller med användning av en catena (en upphängd tråd) över en öppen DMF-anordning.
Digital mikrofluidik kan ljusaktiveras. Optoelektrovätning kan användas för att transportera fastsittande droppar runt en yta som innehåller mönstrade fotoledare . Fotoelektrovätningseffekten kan också användas för att uppnå dropptransport på en kiselskiva utan att mönstrade elektroder behövs .
Arbetsprincip
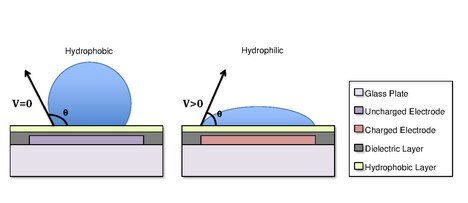
Droppar bildas med hjälp av en vätskas ytspänningsegenskaper . Till exempel kommer vatten som placeras på en hydrofob yta, såsom vaxpapper, att bilda sfäriska droppar för att minimera dess kontakt med ytan. Skillnader i ythydrofobicitet påverkar en vätskas förmåga att spridas och "väta" en yta genom att ändra kontaktvinkeln . När en ytas hydrofobicitet ökar, ökar kontaktvinkeln , och droppens förmåga att väta ytan minskar. Förändringen i kontaktvinkel, och därför vätning, regleras av Young-Lippmann-ekvationen.
där är kontaktvinkeln med en pålagd spänning ; är kontaktvinkeln utan spänning; är den relativa permittiviteten för dielektrikumet; är permittiviteten för ledigt utrymme ; är vätske-/fyllmedelsmediets ytspänning; är den dielektriska tjockleken.
I vissa fall kan hydrofobiciteten hos ett substrat kontrolleras genom att använda elektriska fält. Detta syftar på fenomenet Electrowetting On Dielectric ( EWOD ). [3] [4] Till exempel, när inget elektriskt fält appliceras på en elektrod, kommer ytan att förbli hydrofob och en vätskedroppe kommer att bilda en mer sfärisk droppe med en större kontaktvinkel. När ett elektriskt fält appliceras skapas en polariserad hydrofil yta. Vattendroppen blir då tillplattad och kontaktvinkeln minskar. Genom att kontrollera lokaliseringen av denna polarisation kan vi skapa en gränssnittsspänningsgradient som tillåter kontrollerad förskjutning av droppen över ytan av DMF-enheten.
Droppbildning
Det finns två sätt att göra nya droppar med en digital mikrofluidisk enhet. Antingen kan en befintlig droppe delas i två delar, eller så kan en ny droppe tillverkas av en reservoar av material. Båda processerna är bara kända för att fungera i slutna enheter, även om detta ofta inte är ett problem eftersom toppplattorna på DMF-enheter vanligtvis är borttagbara, så en öppen enhet kan göras tillfälligt stängd om det skulle behövas droppbildning.
Från en befintlig droppe
En droppe kan delas genom att ladda två elektroder på motsatta sidor av en droppe på en oladdad elektrod. På samma sätt kommer en droppe på en oladdad elektrod att röra sig mot en intilliggande laddad elektrod, denna droppe kommer att röra sig mot båda aktiva elektroderna. Vätska rör sig till vardera sidan, vilket får mitten av droppen att halsa. För en droppe av samma storlek som elektroderna kommer splittring att inträffa ungefär när eftersom halsen kommer vara som tunnast. är krökningsradien för meniskerna vid halsen, vilket är negativt för en konkav kurva, och är radien för krökning av meniskerna vid de långsträckta ändarna av droppen. Denna process är enkel och resulterar konsekvent i två droppar med samma volym.
Den konventionella metoden att dela en befintlig droppe genom att helt enkelt slå på och stänga av klyvelektroderna producerar nya droppar med relativt lika volym. De nya dropparna som bildas med den konventionella metoden visar emellertid avsevärda skillnader i volym. Denna skillnad orsakas av lokala störningar på grund av den snabba masstransporten. Även om skillnaden är försumbar i vissa applikationer, kan den fortfarande utgöra ett problem i applikationer som är mycket känsliga för variationer i volym, såsom immunanalyser och DNA-amplifiering. För att övervinna begränsningen hos den konventionella metoden kan en befintlig droppe delas genom att gradvis ändra potentialen hos elektroderna vid delningsområdet istället för att helt enkelt slå på och av dem. Med denna metod har en märkbar förbättring i droppvolymvariation, från cirka 10 % variation i volym till mindre än 1 % variation i volym, rapporterats.
Från en reservoar
Att skapa en ny droppe från en vätskebehållare kan göras på liknande sätt som att dela en droppe. I detta fall förblir behållaren stationär medan en sekvens av elektroder används för att dra ut vätska ur behållaren. Denna dragna vätska och behållaren bildar en vätskehals, liknande halsen på en sprickande droppe men längre, och kollapsningen av denna hals bildar en utmatad droppe från den dragna vätskan. I motsats till delning är dock dispensering av droppar på detta sätt inkonsekvent i skala och resultat. Det finns inget tillförlitligt avstånd som vätska behöver dras från behållaren för att halsen ska kollapsa, om den ens kollapsar alls. Eftersom detta avstånd varierar kommer volymerna av utmatade droppar också att variera inom samma enhet.
På grund av dessa inkonsekvenser har alternativa tekniker för dispensering av droppar använts och föreslagits, inklusive att dra ut vätska ur reservoarer i geometrier som tvingar fram en tunnare hals, använda en kontinuerlig och påfyllningsbar elektrovätningskanal, och att flytta reservoarer i hörn för att skära ner reservoaren mitten. Flera iterationer av den senare kan producera droppar av mer hanterbara storlekar.
Droppe manipulation
Droppet smälter samman
Eftersom en befintlig droppe kan delas för att bilda diskreta droppar med hjälp av elektroder (se Från en befintlig droppe ), kan droppar slås samman till en droppe för elektroder också. Genom att använda samma koncept som tillämpats för att skapa nya droppar genom att dela en befintlig droppe med elektroder, kan en vattendroppe som vilar på en oladdad elektrod röra sig mot en laddad elektrod där dropparna kommer att gå samman och smälta samman till en droppe. Den sammanslagna droppen kanske inte alltid bildar en cirkulär form även efter att sammanslagningsprocessen är över på grund av ytspänning. Detta problem kan lösas genom att implementera en superhydrofob yta mellan dropparna och elektroderna. Oljedroppar kan slås samman på samma sätt också, men oljedroppar kommer att röra sig mot oladdade elektroder till skillnad från vattendroppar.
Droppetransport
Diskreta droppar kan transporteras på ett mycket kontrollerat sätt med hjälp av en rad elektroder. På samma sätt som droppar rör sig från en oladdad elektrod till en laddad elektrod, eller vice versa, kan droppar transporteras kontinuerligt längs elektroderna genom att sekventiellt aktivera elektroderna. Eftersom dropptransport involverar en uppsättning elektroder, kan flera elektroder programmeras för att selektivt anbringa en spänning på varje elektrod för bättre kontroll över transport av flera droppar.
Förskjutning genom elektrostatisk aktivering
Tredimensionell droppaktivering har möjliggjorts genom att implementera ett slutet system; detta system innehåller en droppe av storleken µL i oblandbart flytande medium. Droppen och mediet placeras sedan mellan två elektromagnetiska plattor, vilket skapar ett EM-fält mellan de två plattorna. Syftet med denna metod är att överföra droppen från en nedre plan yta till en övre parallell plan yta och tillbaka ner via elektrostatiska krafter. Fysiken bakom sådan partikelaktivering och vinkelrät rörelse kan förstås från tidiga verk av NN Lebedev och IP Skal'skaya. I sin forskning försökte de modellera den elektriska Maxwell-laddningen som förvärvats av en perfekt rund ledande partikel i närvaro av ett enhetligt magnetfält orsakat av en perfekt ledande och oändligt sträckande yta. Deras modell hjälper till att förutsäga mikrodropparnas rörelse i Z-riktningen i enheten eftersom den pekar på storleken och riktningen av krafter som verkar på en mikrodroppe. Detta kan användas för att förutsäga och korrigera oönskade och okontrollerbara partikelrörelser. Modellen förklarar varför underlåtenhet att använda dielektrisk beläggning på en av de två ytorna orsakar omkastning av laddningen i droppen vid kontakt med varje elektrod och i sin tur får dropparna att okontrollerat studsa mellan elektroderna.
Digital mikrofluidik (DMF) har redan lätt anpassats inom många biologiska områden. Genom att möjliggöra tredimensionell rörelse inom DMF kan tekniken användas ännu mer omfattande i biologiska tillämpningar, eftersom den mer exakt kan efterlikna 3D-mikromiljöer. En stor fördel med att använda denna typ av metod är att den tillåter två olika miljöer att vara tillgängliga för droppen, vilket kan utnyttjas genom att dela upp de mikrofluidiska uppgifterna mellan de två ytorna. Till exempel, medan det nedre planet kan användas för att flytta droppar, kan den övre plattan utföra de nödvändiga kemiska och/eller biologiska processerna. Denna fördel kan översättas till praktiska experimentprotokoll inom det biologiska samhället, såsom koppling med DNA-amplifiering. Detta gör också att chippet kan bli mindre och ge forskare större frihet att designa plattformar för mikrodroppanalys.
Droppaktivering i terräng (ATDA)
All-terrain microfluidics är en metod som används för att transportera vätskedroppar över icke-traditionella yttyper. Till skillnad från traditionell mikrofluidikplattform, som i allmänhet är begränsad till plana och horisontella ytor, möjliggör ATDA droppmanipulation över krökta, icke-horisontella och inverterade ytor. Detta görs möjligt genom att införliva flexibla tunna skivor av koppar och polyimid i ytan via en snabb prototypmetod. Den här enheten fungerar mycket bra med många vätskor, inklusive vattenhaltiga buffertar, lösningar av proteiner och DNA, och outspätt bovint serum. ATDA är kompatibelt med silikonolja eller pluronic-tillsatser, såsom F-68, som minskar ospecifik absorption och biofouling vid hantering av biologiska vätskor som proteiner, biologiska serum och DNA. En nackdel med en sådan uppsättning är accelererad droppavdunstning. ATDA är en form av öppen digital mikrofluidik, och som sådan måste enheten kapslas in i en fuktad miljö för att minimera droppavdunstning.
Genomförande
I en av olika utföringsformer av EWOD-baserade mikrofluidiska biochips, som först undersöktes av Cytonix 1987 [ 1] och sedan kommersialiserats av Advanced Liquid Logic, finns det två parallella glasplattor. Bottenplattan innehåller en mönstrad grupp av individuellt styrbara elektroder och toppplattan är belagd med en kontinuerlig jordningselektrod . En dielektrisk isolator belagd med en hydrofob läggs till plattorna för att minska ytans vätbarhet och för att lägga till kapacitans mellan droppen och kontrollelektroden. Den droppe som innehåller biokemiska prover och fyllmedelsmediet, såsom silikonolja , en fluorerad olja eller luft, är inlagda mellan plattorna och dropparna färdas inuti fyllmedelsmediet. För att flytta en droppe läggs en styrspänning på en elektrod intill droppen och samtidigt avaktiveras elektroden strax under droppen. Genom att variera den elektriska potentialen längs en linjär uppsättning av elektroder, kan elektrovätning användas för att flytta droppar längs denna linje av elektroder.
Ansökningar
Laboratorieautomation
Inom forskningsområden som syntetisk biologi , där mycket iterativt experimenterande är vanligt, har stora ansträngningar gjorts för att automatisera arbetsflöden. Digital mikrofluidik säljs ofta som en laboratorieautomatiseringslösning, med ett antal fördelar jämfört med alternativa lösningar som pipetteringsrobotar och droppmikrofluidik . Dessa angivna fördelar inkluderar ofta en minskning av den erforderliga volymen av experimentella reagenser, en minskning av sannolikheten för kontaminering och korskontaminering, potentiella förbättringar av reproducerbarhet, ökad genomströmning, individuella droppar adresserbarhet och förmågan att integrera med sensor- och detektormoduler för att utföra end-to-end eller till och med sluten slinga arbetsflödesautomatisering.
Minskat experimentellt fotavtryck
En av de centrala fördelarna med digital mikrofluidik, och med mikrofluidik i allmänhet, är användningen och aktiveringen av picoliter till mikroliter skala volymer. Arbetsflöden anpassade från bänken till ett DMF-system är miniatyriserade, vilket innebär att arbetsvolymerna reduceras till bråkdelar av vad som normalt krävs för konventionella metoder. Till exempel, Thaitrong et al. utvecklat ett DMF-system med en kapillärelektrofores (CE) modul i syfte att automatisera processen för nästa generations sekvensering (NGS) bibliotekskarakterisering. Jämfört med en Agilent BioAnalyzer (ett instrument som vanligtvis används för att mäta sekvenseringsbibliotekets storleksfördelning) förbrukade DMF-CE-systemet tio gånger mindre provvolym. Att minska volymerna för ett arbetsflöde kan vara särskilt fördelaktigt om reagenserna är dyra eller vid manipulering av sällsynta prover som cirkulerande tumörceller och prenatala prover. Miniatyrisering innebär också en minskning av restproduktvolymerna.
Minskad sannolikhet för kontaminering
DMF-baserade arbetsflöden, särskilt de som använder en sluten konfiguration med en jordelektrod med toppplatta, har visat sig vara mindre mottagliga för yttre förorening jämfört med vissa konventionella laboratoriearbetsflöden. Detta kan hänföras till minimal användarinteraktion under automatiserade steg, och det faktum att de mindre volymerna är mindre exponerade för miljöföroreningar än större volymer som skulle behöva utsättas för fri luft vid blandning. Ruan et al. observerade minimal kontaminering från exogent icke-humant DNA och ingen korskontaminering mellan prover medan de använde deras DMF-baserade digitala helgenomsekvenseringssystem.
Förbättrad reproducerbarhet
Att övervinna frågor om reproducerbarhet har blivit ett ämne av växande oro över vetenskapliga discipliner. Reproducerbarhet kan vara särskilt framträdande när flera iterationer av samma experimentella protokoll måste upprepas. Att använda vätskehanteringsrobotar som kan minimera volymförluster mellan experimentstegen används ofta för att minska felfrekvensen och förbättra reproducerbarheten. Ett automatiserat DMF-system för CRISPR-Cas9- genomredigering beskrevs av Sinha et al, och användes för att odla och genetiskt modifiera H1299 -lungcancerceller. Författarna noterade att ingen variation i knockout-effektivitet över loci observerades när celler odlades på DMF-anordningen, medan celler odlade i brunnsplattor visade variabilitet i uppströms loci knockout-effektivitet. Denna minskning i variabilitet tillskrevs att odling på en DMF-anordning var mer homogen och reproducerbar jämfört med brunnsplatmetoder.
Ökad genomströmning
Även om DMF-system inte kan matcha samma genomströmning som uppnås av vissa vätskehanteringspipetteringsrobotar, eller av vissa droppbaserade mikrofluidsystem, finns det fortfarande genomströmningsfördelar jämfört med konventionella metoder som utförs manuellt.
Adresserbarhet för individuella droppar
DMF möjliggör adresserbarhet på droppnivå, vilket innebär att enskilda droppar kan behandlas som rumsligt distinkta mikroreaktorer . Denna nivå av droppkontroll är viktig för arbetsflöden där reaktioner är känsliga för ordningen av reagensblandning och inkubationstider, men där de optimala värdena för dessa parametrar fortfarande kan behöva bestämmas. Dessa typer av arbetsflöden är vanliga inom cellfri biologi , och Liu et al. kunde demonstrera en proof-of-concept DMF-baserad strategi för att utföra fjärrstyrt cellfritt proteinuttryck på ett OpenDrop-chip.
Detektormodulintegrering för end-to-end och sluten slinga automation
En ofta nämnt fördel som DMF-plattformar har är deras potential att integreras med on-chip-sensorer och off-chip-detektormoduler. I teorin kan realtids- och slutpunktsdata användas i kombination med maskininlärningsmetoder för att automatisera processen för parameteroptimering.
Separation och extraktion
Digital mikrofluidik kan användas för separation och extraktion av målanalyter. Dessa metoder inkluderar användning av magnetiska partiklar, vätske-vätskeextraktion , optisk pincett och hydrodynamiska effekter .
Magnetiska partiklar
För magnetiska partikelseparationer placeras en droppe lösning innehållande analyten av intresse på en digital mikrofluidikelektroduppsättning och flyttas av förändringarna i elektrodernas laddningar. Droppen flyttas till en elektrod med en magnet på ena sidan av arrayen med magnetiska partiklar funktionaliserade för att binda till analyten. Därefter förs den över elektroden, magnetfältet avlägsnas och partiklarna suspenderas i droppen. Droppen virvlas på elektroduppsättningen för att säkerställa blandning. Magneten återinförs och partiklarna immobiliseras och droppen flyttas bort. Denna process upprepas med tvätt- och elueringsbuffertar för att extrahera analyten.
Magnetiska partiklar belagda med antihumana serumalbuminantikroppar har använts för att isolera humant serumalbumin, som bevis på konceptarbete för immunoutfällning med användning av digital mikrofluidik. 5 DNA-extraktion från ett helblodsprov har också utförts med digital mikrofluidik. 3 Proceduren följer den allmänna metoden som magnetiska partiklar, men inkluderar förbehandling på den digitala mikrofluidiska plattformen för att lysera cellerna före DNA-extraktion.
Vätske-vätskeextraktion
Vätske-vätskeextraktioner kan utföras på digital mikrofluidisk enhet genom att dra fördel av oblandbara vätskor. 9 Två droppar, en som innehåller analyten i vattenfas och den andra en oblandbar jonisk vätska finns på elektrodgruppen. De två dropparna blandas och den joniska vätskan extraherar analyten, och dropparna är lätta att separera.
Optisk pincett
Optisk pincett har också använts för att separera celler i droppar. Två droppar blandas på en elektroduppsättning, en som innehåller cellerna och den andra med näringsämnen eller läkemedel. Dropparna blandas och sedan används en optisk pincett för att flytta cellerna till ena sidan av den större droppen innan den delas. För en mer detaljerad förklaring av de underliggande principerna, se Optisk pincett .
Hydrodynamisk separation
Partiklar har använts för användning utanför magnetisk separation, med hydrodynamiska krafter för att separera partiklar från huvuddelen av en droppe. Detta utförs på elektroduppsättningar med en central elektrod och "skivor" av elektroder som omger den. Droppar tillsätts på arrayen och virvlas i ett cirkulärt mönster, och de hydrodynamiska krafterna från virvlingen gör att partiklarna aggregerar på den centrala elektroden.
Kemisk syntes
Digital Microfluidics (DMF) möjliggör exakt manipulation och koordinering i småskaliga kemiska syntesreaktioner på grund av dess förmåga att kontrollera mikroskala volymer av flytande reagens, vilket möjliggör totalt sett mindre reagensanvändning och avfall. Denna teknologi kan användas i syntesföreningar såsom peptidomimetika och PET -spårämnen. PET- spårämnen kräver nanogramkvantiteter och som sådan möjliggör DMF automatiserad och snabb syntes av spårämnen med 90-95 % effektivitet jämfört med konventionella makroskalatekniker.
Organiska reagenser används inte vanligtvis i DMF eftersom de tenderar att väta DMF-anordningen och orsaka översvämning; syntes av organiska reagens kan emellertid uppnås genom DMF-tekniker genom att transportera de organiska reagensen genom en jonisk vätskedroppe, vilket på så sätt förhindrar det organiska reagenset från att svämma över DMF-anordningen. Droppar kombineras genom att inducera motsatta laddningar och attraherar dem till varandra. Detta möjliggör automatisk blandning av droppar. Blandning av droppar används också för att deponera MOF- kristaller för utskrift genom att tillföra reagenser i brunnar och indunsta lösningarna för kristallavsättning. Denna metod för MOF- kristallavsättning är relativt billig och kräver ingen omfattande robotutrustning.
Kemisk syntes med användning av digital mikrofluidik (DMF) har tillämpats på många anmärkningsvärda biologiska reaktioner. Dessa inkluderar polymeraskedjereaktion (PCR), såväl som bildandet av DNA och peptider . Reduktion, alkylering och enzymatisk nedbrytning har också visat robusthet och reproducerbarhet med användning av DMF, vilket indikerar potential i syntes och manipulation av proteomik . Spektra erhållna från produkterna från dessa reaktioner är ofta identiska med deras biblioteksspektra, medan de endast använder en liten del av reaktanter i bänkskala. Att genomföra dessa synteser i mikroskala har således fördelen av att begränsa pengar som spenderas på att köpa reagens och avfallsprodukter som produceras samtidigt som det ger önskvärda experimentella resultat. Men många utmaningar måste övervinnas för att driva dessa reaktioner till slut genom DMF. Det har förekommit rapporter om minskad effektivitet i kemiska reaktioner jämfört med versioner i bänkskala av samma synteser, eftersom lägre produktutbyten har observerats. Dessutom, eftersom pikoliter- och nanoliterstorleksprover måste analyseras, måste alla instrument som används i analysen ha hög känslighet. Dessutom är systeminstallationen ofta svår på grund av omfattande mängder ledningar och pumpar som krävs för att driva mikrokanaler och reservoarer. Slutligen utsätts prover ofta för lösningsmedelsavdunstning, vilket leder till förändringar i volym och koncentration av reaktanter, och i vissa fall reaktioner som inte fullbordas.
Sammansättningen och renheten hos molekyler som syntetiseras av DMF bestäms ofta med användning av klassiska analytiska tekniker. Kärnmagnetisk resonans (NMR) spektroskopi har framgångsrikt tillämpats för att analysera motsvarande intermediärer, produkter och reaktionskinetik. Ett potentiellt problem som uppstår genom användning av NMR är låg masskänslighet, men detta kan korrigeras genom att använda mikrospolar som hjälper till att särskilja molekyler med olika massor. Detta är nödvändigt eftersom signal-till-brusförhållandet för provstorlekar i mikroliter till nanoliter-området är dramatiskt reducerat jämfört med provstorlekar i bänkskala, och mikrospolar har visat sig lösa detta problem. Masspektrometri (MS) och högpresterande vätskekromatografi (HPLC) har också använts för att övervinna denna utmaning. Även om MS är en attraktiv analytisk teknik för att särskilja produkterna av reaktioner som åstadkoms genom DMF, utgör den sina egna svagheter. Matrix-assisterad laserdesorption jonisering (MALDI) och elektrospray jonisering (ESI) MS har nyligen parats med att analysera mikrofluidiska kemiska reaktioner. Emellertid leder kristallisation och utspädning i samband med dessa metoder ofta till ogynnsamma biverkningar, såsom provförlust och uppträdande bireaktioner. Användningen av MS i DMF diskuteras mer i detalj i ett senare avsnitt.
Cell kultur
Anslutning av DMF-chippet för användning i fält eller värld-till-chip-gränssnitt har åstadkommits med hjälp av manuella pumpar och reservoarer som levererar mikrober, celler och media till enheten. Avsaknaden av omfattande pumpar och ventiler möjliggör utarbetade flerstegsapplikationer som involverar celler utförda i ett enkelt och kompakt system. I en applikation har mikrobiella kulturer överförts till chipet och fått växa med hjälp av sterila procedurer och temperatur som krävs för mikrobiell inkubation. För att validera att detta var ett livskraftigt utrymme för mikrobiell tillväxt utfördes en transformationsanalys i enheten. Detta innebär att E.coli exponeras för en vektor och värmechockar bakterierna tills de tar upp DNA:t. Detta följs sedan av att köra en DNA-gel för att säkerställa att den önskade vektorn togs upp av bakterierna. Denna studie fann att DNA verkligen togs upp av bakterierna och uttrycks som förutspått.
Mänskliga celler har också manipulerats i Digital Microfluidic Immunocytochemistry in Single Cells (DISC) där DMF-plattformar användes för att odla och använda antikroppar för att märka fosforylerade proteiner i cellen. Odlade celler avlägsnas sedan och tas bort från chipet för screening. En annan teknik syntetiserar hydrogeler inom DMF-plattformar. Denna process använder elektroder för att leverera reagens för att producera hydrogelen, och leverans av cellodlingsreagenser för absorption i gelén. Hydrogelerna är en förbättring jämfört med 2D-cellkultur eftersom 3D-cellkultur har ökade cell-cell-interaktioner och cel-extracellulära matrix-interaktioner . Sfäriska cellkulturer är en annan metod utvecklad kring förmågan hos DMF att leverera droppar till celler. Applicering av en elektrisk potential möjliggör automatisering av droppöverföring direkt till den hängande cellkulturen. ] Detta är fördelaktigt eftersom 3-dimensionell cellkultur och sfäroider bättre efterliknar in vivo-vävnad genom att möjliggöra mer biologiskt relevanta kulturer som har celler som växer i en extracellulär matris som liknar den i människokroppen. En annan användning av DMF-plattformar i cellkultur är dess förmåga att utföra cellfri kloning in vitro med PCR med en enda molekyl inuti droppar. PCR- amplifierade produkter valideras sedan genom transfektion i jästceller och en Western blot-proteinidentifiering.
Problem som uppstår från cellodlingsapplikationer som använder DMF inkluderar proteinadsorption till enhetens golv och cytotoxicitet till celler. För att förhindra adsorption av protein till plattformens golv användes en ytaktivt stabiliserad kiselolja eller hexan för att belägga enhetens yta, och dropparna manipulerades ovanpå oljan eller hexanen. Hexan avdunstades senare snabbt från kulturer för att förhindra en toxisk effekt på cellkulturer. Ett annat sätt att lösa proteinvidhäftning är tillsatsen av Pluronic -tillsatser till droppar i enheten. Pluronic tillsatser är i allmänhet inte cytotoxiska men vissa har visat sig vara skadliga för cellkulturer.
Biokompatibilitet för enhetens uppsättning är viktig för biologiska analyser. Tillsammans med att hitta Pluronic-tillsatser som inte är cytotoxiska, skapades en enhet vars spänning och störande rörelse inte skulle påverka cellviabiliteten. Genom avläsningen av levande/döda analyser visades det att varken spänning som krävs för att flytta droppar eller rörelsen av rörliga kulturer påverkade cellviabiliteten.
Biologisk utvinning
Biologiska separationer involverar vanligtvis lågkoncentrerade högvolymprover. Detta kan utgöra ett problem för digital mikrofluidik på grund av den lilla provvolymen som krävs. Digitala mikrofluidsystem kan kombineras med ett makrofluidiskt system utformat för att minska provvolymen, vilket i sin tur ökar analytkoncentrationen. Den följer samma principer som de magnetiska partiklarna för separation, men inkluderar pumpning av droppen för att cirkulera en större volym vätska runt de magnetiska partiklarna. Extraktion av läkemedelsanalyter från torkade urinprover har också rapporterats. En droppe extraktionslösningsmedel, i detta fall metanol, flödar upprepade gånger över ett prov av torkat urinprov och flyttas sedan till en slutlig elektrod där vätskan extraheras genom en kapillär och sedan analyseras med masspektrometri.
Immunanalyser
De avancerade vätskehanteringsmöjligheterna hos digital mikrofluidik (DMF) gör det möjligt att använda DMF som en immunanalysplattform eftersom DMF-enheter exakt kan manipulera små mängder flytande reagens. Både heterogena immunanalyser (antigener som interagerar med immobiliserade antikroppar) och homogena immunanalyser (antigener som interagerar med antikroppar i lösning) har utvecklats med hjälp av en DMF-plattform. När det gäller heterogena immunanalyser kan DMF förenkla de utökade och intensiva procedurstegen genom att utföra alla leverans-, blandnings-, inkubations- och tvättsteg på enhetens yta (på chip). Vidare har existerande immunanalystekniker och -metoder, såsom magnetiska pärlorbaserade analyser, ELISA och elektrokemisk detektion, införlivats på DMF-immunanalysplattformar.
Införlivandet av magnetiska pärlor-baserade analyser på en DMF-immunanalysplattform har visats för detektering av flera analyter, såsom humaninsulin, IL-6, hjärtmarkör Troponin I (cTnI), sköldkörtelstimulerande hormon (TSH), sTNF-RI och 17p-östradiol. Till exempel har en magnetisk pärla-baserad tillvägagångssätt använts för att detektera cTnI från helblod på mindre än 8 minuter. Kortfattat blandades magnetiska pärlor innehållande primära antikroppar med märkta sekundära antikroppar, inkuberades och immobiliserades med en magnet för tvättstegen. Droppen blandades sedan med ett kemiluminescerande reagens och detektion av den åtföljande enzymatiska reaktionen mättes på chipet med ett fotomultiplikatorrör .
ELISA-mallen, som vanligtvis används för att utföra immunanalyser och andra enzymbaserade biokemiska analyser, har anpassats för användning med DMF-plattformen för detektion av analyter som IgE och IgG. I ett exempel utfördes en serie bioanalyser för att fastställa kvantifieringsförmågan hos DMF-enheter, inklusive en ELISA-baserad immunanalys för detektion av IgE. Superparamagnetiska nanopartiklar immobiliserades med anti-IgE-antikroppar och fluorescensmärkta aptamerer för att kvantifiera IgE med hjälp av en ELISA-mall. På liknande sätt, för detektion av IgG, kan IgG immobiliseras på ett DMF-chip, konjugeras med pepparrotsperoxidas (HRP)-märkt IgG och sedan kvantifieras genom mätning av färgförändringen associerad med produktbildning av reaktionen mellan HRP och tetrametylbensidin.
För att ytterligare utöka kapaciteten och tillämpningarna av DMF-immunanalyser bortom kolorimetrisk detektion (dvs ELISA, magnetiska pärlor-baserade analyser), har elektrokemiska detektionsverktyg (t.ex. mikroelektroder) inkorporerats i DMF-chips för detektering av analyter som TSH och rubellavirus . Till exempel har Rackus et al. integrerade mikroelektroder på en DMF-chipyta och ersatte en tidigare rapporterad kemiluminescerande IgG-immunanalys med en elektroaktiv art, vilket möjliggör detektering av rubellavirus. De belade magnetiska pärlor med röda hundvirus, anti-röda hund IgG och anti-humant IgG i kombination med alkaliskt fosfatas, vilket i sin tur katalyserade en elektronöverföringsreaktion som detekterades av mikroelektroderna på chipet.
Masspektrometri
Kopplingen av digital mikrofluidik (DMF) och masspektrometri kan till stor del kategoriseras i indirekt off-line analys, direkt off-line analys och in-line analys och de främsta fördelarna med denna koppling är minskad användning av lösningsmedel och reagens, samt minskade analystider.
Indirekt off-line analys är användningen av DMF-enheter för att kombinera reaktanter och isolera produkter, som sedan tas bort och manuellt överförs till en masspektrometer. Detta tillvägagångssätt drar fördel av DMF för provberedningssteget men introducerar också möjligheter till kontaminering eftersom manuella ingrepp krävs för att överföra provet. I ett exempel på denna teknik utfördes en Grieco trekomponentskondensering på chip och togs bort från chipet med mikropipett för släckning och vidare analys.
Direkt off-line analys är användningen av DMF-enheter som har tillverkats och inkorporerats delvis eller helt i en masspektrometer. Denna process anses fortfarande vara offline, men eftersom vissa efterreaktionsprocedurer kan utföras manuellt (men på chip), utan användning av enhetens digitala kapacitet. Sådana enheter används oftast i konjugering med MALDI-MS . I MALDI-baserade direkt off-line-enheter måste droppen torkas och omkristalliseras tillsammans med matris – operationer som ofta kräver vakuumkammare. Chipet med kristalliserad analyt placeras sedan i MALDI-MS för analys. En fråga som tagits upp med MALDI-MS-koppling till DMF är att matrisen som krävs för MALDI-MS kan vara mycket sur, vilket kan störa reaktionerna på chipet
Inline-analys är användningen av enheter som matas direkt in i masspektrometrar, vilket eliminerar all manuell manipulation. Inline-analys kan kräva specialtillverkade enheter och anslutningshårdvara mellan enheten och masspektrometern. Inline-analys kombineras ofta med elektrosprayjonisering . I ett exempel tillverkades ett DMF-chip med ett hål som ledde till en mikrokanal. Denna mikrokanal var i sin tur kopplad till en elektrosprayjonisator som avgav direkt in i en masspektrometer. Integrationstekniker för omgivande jonisering där joner bildas utanför masspektrometern med liten eller ingen behandling passar väl ihop med den öppna eller halvöppna mikrofluidiska naturen hos DMF och möjliggör enkel inline-koppling mellan DMF- och MS-system. Omgivande joniseringstekniker såsom Surface Acoustic Wave (SAW) jonisering genererar ytvågor på en plan piezoelektrisk yta som ger tillräckligt med akustisk energi på vätskegränsytan för att övervinna ytspänningen och desorbera joner från chipet in i massanalysatorn. Vissa kopplingar använder en extern högspänningspulskälla vid det fysiska inloppet till masspektrometern, men den verkliga rollen av sådana tillägg är osäker.
En betydande barriär för den utbredda integrationen av DMF med masspektrometri är biologisk kontaminering, ofta kallad bio-fouling. Analys med hög genomströmning är en betydande fördel vid användning av DMF-system, men innebär att de är särskilt känsliga för korskontaminering mellan experiment. Som ett resultat kräver kopplingen av DMF med masspektrometri ofta integrering av en mängd olika metoder för att förhindra korskontaminering såsom flera tvättsteg, biologiskt kompatibla ytaktiva ämnen och/eller superhydrofoba ytor för att förhindra droppadsorption. I ett exempel krävde en minskning av korskontaminantsignalen under karakteriseringen av en aminosyra 4-5 tvättsteg mellan varje provdroppe för att kontamineringsintensiteten skulle falla under detektionsgränsen.
Miniatyrmasspektrometrar
Konventionella masspektrometrar är ofta stora såväl som oöverkomligt dyra och komplexa i sin funktion, vilket har lett till den ökade attraktiviteten hos miniatyrmasspektrometrar (MMS) för en mängd olika tillämpningar. MMS är optimerade för överkomliga priser och enkel drift, ofta avstår de från behovet av erfarna tekniker, har en låg tillverkningskostnad och är tillräckligt liten i storlek för att möjliggöra överföring av datainsamling från laboratoriet till fältet. Dessa fördelar kommer ofta på bekostnad av minskad prestanda där MMS-upplösning, såväl som gränserna för detektion och kvantifiering, ofta knappt är tillräckliga för att utföra specialiserade uppgifter. Integrationen av DMF med MMS har potential för betydande förbättringar av MMS-system genom att öka genomströmningen, upplösningen och automatiseringen, samtidigt som lösningsmedelskostnaden minskar, vilket möjliggör analys av laboratoriekvalitet till en mycket reducerad kostnad. I ett exempel har användningen av ett anpassat DMF-system för urinläkemedelstestning möjliggjort skapandet av ett instrument som bara väger 25 kg med prestanda jämförbar med standard laboratorieanalys.
Kärnmagnetisk resonansspektroskopi
Kärnmagnetisk resonans (NMR)-spektroskopi kan användas tillsammans med digital mikrofluidik (DMF) genom användning av NMR-mikrospolar, som är elektromagnetiskt ledande spolar som är mindre än 1 mm i storlek. På grund av sin storlek har dessa mikrospolar flera begränsningar, som direkt påverkar känsligheten hos maskineriet de arbetar inom.
Mikrokanal/mikrospole-gränssnitt, före digital mikrofluidik, hade flera nackdelar, såsom att många skapade stora mängder lösningsmedelsavfall och lätt förorenades. På detta sätt är användningen av digital mikrofluidik och dess förmåga att manipulera singlettdroppar lovande.
Gränssnittet mellan digital mikrofluidik och NMR- relaxometri har lett till skapandet av system som de som används för att detektera och kvantifiera koncentrationerna av specifika molekyler på mikroskala med vissa sådana system som använder tvåstegsprocesser där DMF-enheter leder droppar till NMR-detektionsplatsen. Introduktionssystem för högfälts-NMR och 2D-NMR i samband med mikrofluidik har också utvecklats. Dessa system använder enplatta DMF-enheter med NMR-mikrospoler i stället för den andra plattan. Nyligen inkluderade ytterligare modifierad version av detta gränssnitt pulserade fältgradienter (PFG) enheter som gjorde det möjligt för denna plattform att utföra mer sofistikerade NMR-mätningar (t.ex. NMR-diffusometri, gradientkodade pulsmätningar). Detta system har framgångsrikt tillämpats för att övervaka snabba organiska reaktioner.