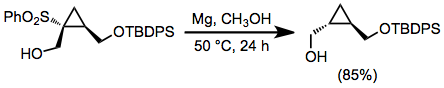Desulfonyleringsreaktioner
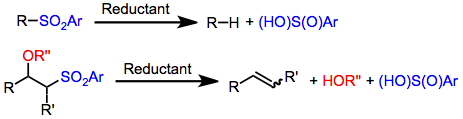
Desulfonyleringsreaktioner är kemiska reaktioner som leder till avlägsnande av en sulfonylgrupp från organiska föreningar . Eftersom den funktionella sulfonylgruppen är elektronåtdragande , är metoder för att klyva svavel -kolbindningarna i sulfoner vanligtvis reduktiva till sin natur. Olefinering eller ersättning med väte kan åstadkommas med användning av reduktiva desulfonyleringsmetoder.
Introduktion
Den funktionella sulfonylgruppen (RS(O) 2R ') har blivit en viktig elektronbortdragande grupp för modern organisk kemi. a-sulfonylkarbanjoner kan användas som nukleofiler i alkyleringsreaktioner, tillägg av Michael-typ och andra processer. Efter att ha tjänat sitt syntetiska syfte, avlägsnas ofta sulfonylgrupper. I närvaro av vissa reduktionsmedel spjälkas en av svavel-kolbindningarna i sulfonylgruppen, vilket leder till svavelfria organiska produkter. Beroende på substratets natur och reaktionsbetingelser ger alkylsulfoner antingen motsvarande alkaner eller olefiner ( Julia-olefineringen) . Reduktiv desulfonylering åstadkommes vanligtvis med aktiva metaller eller salter ( natriumamalgam , aluminiumamalgam , magnesium , samarium(II)jodid ), tennhydrider ( tributyltennhydrid ) eller övergångsmetallkomplex med reduktionsmedel eller nukleofiler (PdCl 2 (Hppp/Li) 3 , Pd(PPh3 ) 4 / LiHBEt3 , Pd (PPh3 ) 4 / NaHC(CO2Et ) 2 ) . Alkyl-, alkenyl- och allylsulfoner kan reduceras med användning av en eller flera av dessa metoder.
(1)
Mekanism och stereokemi
Reduktiv desulfonylering
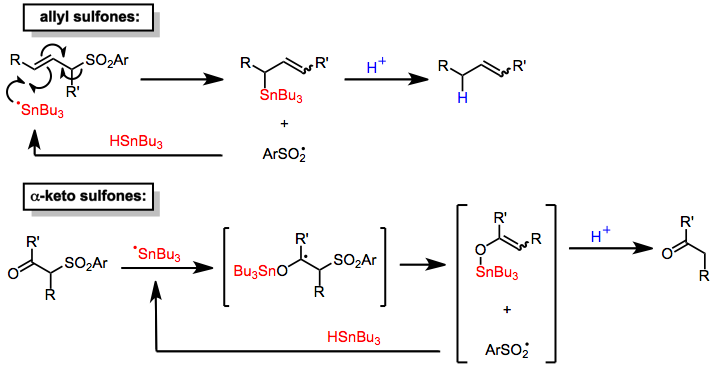
Reduktiva desulfonyleringsreaktioner leder till att en kol-svavelbindning i sulfonylgruppen ersätts med en kol -vätebindning. Eftersom sulfonylgruppen per definition är bunden till två kol, är reduktion till två uppsättningar av produkter emellertid möjlig. Mekanistiska studier av reduktioner som använder metallamalgam som reduktionsmedel tyder på att vid elektronöverföring till sulfonen sker fragmentering till en sulfinatanjon och den mer stabila organiska radikalen. Omedelbar reduktion av radikalen och protonering sker sedan för att ge den svavelfria produkten som härrör från den mer stabila radikalen. Sålunda klyvs S-alkylbindningar i stället för S-aryl- eller S-alkenylbindningar.
-
()
Samarium(II)jodid kan användas för att reduktivt klyva a-ketosulfoner; i närvaro av hexametylfosforamid (HMPA) kan SmI2 åstadkomma reduktiv eliminering av a-funktionaliserade sulfoner (se ekvation ( 11 ) nedan).
-
()
Tennhydrider reducerar α-keto- och allylsulfoner . Mekanismerna för dessa processer involverar tillsats av en tenncentrerad radikal till substratet följt av eliminering av en sulfinylradikal, som abstraherar ett väte från en molekyl av tennhydrid för att fortplanta radikalkedjan. Protonering av de sålunda bildade tennorganiska intermediärerna (av sulfinsyra genererad in situ ) leder till reducerade produkter. Tillsats av en stökiometrisk mängd av protonkälla tillåter användning av tennhydrid i katalytiska mängder. Även om desulfonyleringar av allyliska sulfoner är platsselektiva (som endast tillhandahåller produkter av allylisk transposition), är de inte stereoselektiva och ger blandningar av dubbelbindningsisomerer . Mekanismen för desulfonylering av a-ketosulfoner är liknande.
-
()
Övergångsmetallmedierade reduktiva desulfonyleringar är beroende av genereringen av ett intermediärt π-allylkomplex, som genomgår nukleofil attack av hydrid eller annan nukleofil för att ge reducerade produkter. Nukleofil attack inträffar i allmänhet vid den mindre substituerade positionen av π-allyldelen, även om platsselektiviteten beror starkt på substratet och reaktionsbetingelserna. Palladium (0)-komplex är de mest använda förkatalysatorerna.
-
()
Reduktiv eliminering
Sulfoner med en bra lämnande grupp i β-position kan genomgå reduktiv eliminering under desulfonyleringsbetingelser för att ge alkener . Denna process är ett nyckelsteg i Julia-olefineringen , som ger alkener via tillsats av en a-sulfonylkarbanjon till en aldehyd följt av reduktiv eliminering. Natriumamalgam eller samarium (II)jodid/HMPA kan användas för att omvandla β-sulfonyloxi- eller β- acyloxisulfoner till motsvarande alkener. Det nyckelmekanistiska steget i denna process är eliminering av en anjonisk eller organometallisk mellanprodukt för att generera alkenen.
(6)
Användningen av natriumamalgam, som främjar bildningen av väsentligen fria alkylanjoner, leder till ( E ) alkener med extremt hög selektivitet. Samarium(II)jodid producerar också ( E )-alkenen övervägande, men med lägre selektivitet.
Omfattning och begränsningar
Med användning av lämpliga reagens och betingelser kan alkyl-, alkenyl-, allyl- och a-ketosulfoner reduceras i bra utbyte och hög stereoselektivitet (där tillämpligt). Lämpliga betingelser för reduktion av dessa klasser av sulfoner diskuteras nedan.
Alkylsulfoner kan reduceras med natrium eller litium i flytande ammoniak ; emellertid representerar de starkt grundläggande förhållandena för dessa upplösande metallreduktioner en betydande nackdel. I alkoholhaltiga lösningsmedel magnesiummetall och en katalytisk mängd kvicksilver (II)klorid användas. En mängd olika funktionella grupper är opåverkade av dessa tillstånd, inklusive många som omvandlas genom att lösa metallreduktioner. Reduktiv desulfonylering med dessa reagens förekommer inte i reaktioner av β-hydroxisulfoner, på grund av hydroxylgruppens dåliga förmåga att lämna grupp.
-
()
En betydande fråga förknippad med reduktionen av allylsulfoner är transponering av den allyliska dubbelbindningen, som sker i varierande mängder under reduktioner med metallamalgam. och tennhydrider Palladium-katalyserade reduktiva desulfonyleringar av allyliska sulfoner har inte detta problem och ger allyliska sulfoner med hög plats- och stereoselektivitet.
-
()
Aluminiumamalgam (Al/Hg) kan användas för kemoselektiv reduktion av a-sulfonylerade karbonylgrupper. Karboxylsyraderivat , acetaler, tioacetaler , aminer, alkoholer och isolerade dubbelbindningar är alla inerta mot Al/Hg. Selektiv desulfonylering kan utföras på p-hydroxisulfoner utan reduktiv eliminering.
-
()
Övergångsmetallkatalys är också användbar för stereospecifik reduktion av alkenylsulfoner. I närvaro av ett överskott av ett Grignard -reagens, en palladium(II)- eller nickel- (II)-katalysator och en fosfor- eller kväveligand, omvandlas alkenylsulfoner till motsvarande alkener stereospecifikt med gott utbyte. Å andra sidan är upplösning av metall och metallamalgamreduktioner inte stereoselektiva i allmänhet. Palladiumkatalys är i allmänhet överlägsen nickelkatalys, vilket ger högre utbyten och stereoselektiviteter.
-
()
Alkyl- och alkenylsulfoner med goda lämnande grupper i p-positionen genomgår eliminering under reduktiva betingelser för att ge alkener eller alkyner. Julia -olefineringen utnyttjar denna process för syntes av alkener från alkylsulfoner och karbonylföreningar. Tillsats av en a-sulfonylanjon till en karbonylförening, följt av släckning med en acyl- eller sulfonylklorid, leder till en β-acyloxi eller -sulfonyloxisulfon, som genomgår eliminering under reduktiva betingelser. Natriumamalgam kan användas för att utföra elimineringssteget; Men kombinationen av samarium(II)jodid och HMPA är mildare än starkt basiskt natriumamalgam och leder till högre utbyten i reduktiva elimineringsprocesser.
-
()
Syntetiska applikationer
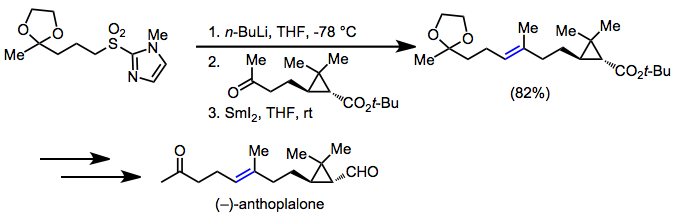
Den blygsamma surheten hos kol som gränsar till sulfonylgruppen har gjort sulfoner användbara för organisk syntes . Vid avlägsnande av sulfonylgruppen med desulfonylering eller reduktiv eliminering är nettoresultatet bildandet av en kol-kolbindning enkel- eller dubbelbindning mellan två ofunktionaliserade kol, ett allestädes närvarande motiv i syntetiska mål. I en syntes av (–)-antoplalon användes Julia-olefinering för att etablera ( E )-alkenen i målet.
(12)
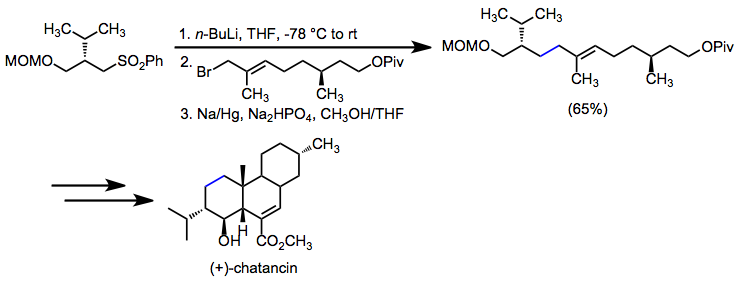
Reduktiv desulfonylering används när upprättandet av en kol-kol enkelbindning är målet. I en syntes av (+)-chatancin etablerade alkylering av en a-sulfonylkarbanjon följt av desulfonylering en nyckelallylisk kol-kolbindning.
(13)
Jämförelse med andra metoder
Eftersom a-cyanokarbanjoner kan användas i många av samma sammanhang som a-sulfonylanjoner, erbjuder reduktiva decyaneringsmetoder ett gångbart alternativ till reduktiv desulfonylering. Lösande metallreduktioner är mest användbara för decyanering av tertiära nitriler (primära och sekundära nitriler ger motsvarande aminer förutom decyanerade produkter), men kalium är ett mer allmänt reduktionsmedel som reducerar primära, sekundära och tertiära nitriler.
(14)
En mängd olika karbonylolefineringsmetoder som är direkta alternativ till Julia-olefineringen är kända: Wittig-reaktionen , Horner -Wadsworth-Emmons-reaktionen , Peterson-olefineringen och andra. Den primära fördelen med Julia-olefinering är att sulfonprekursorerna ibland är mer lättillgängliga och lättare att rena än motsvarande fosfor- eller kiselinnehållande föreningar. Dessutom finns en mängd olika metoder för att syntetisera sulfoner. Icke desto mindre kan den ibland begränsade stereoselektiviteten (och i synnerhet svårigheten att komma åt ( Z )-alkener) av Julia-reaktionen vara problematisk. Många alternativa metoder för olefinering, inklusive Peterson-reaktionen, har inte detta problem.
(15)
![{\displaystyle {\begin{aligned}{\ce {ArSO2R->[+{\ce {e^{-}}}]{[ArSO2R]^{.-}}->{ArSO2^{-}}+}}\ &{\ce {R^{.}}}\\&{\ce {R^{.}->[+{\ce {e^{-}}}][{\ce {H-solv}}]R-H}}\\\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af990b4b965c4b6ecf4e38875554dc167745a312)