Curacin A
 | |
| Identifierare | |
|---|---|
| |
| CAS-nummer | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Kemiska och fysikaliska data | |
| Formel | C 23 H 35 N O S |
| Molar massa | 373,60 g·mol -1 |
| 3D-modell ( JSmol ) | |
| |
| |
Curacin A är en naturlig produkt härledd av hybridpolyketidsyntas (PKS)/ icke-ribosomalt peptidsyntas (NRPS) framställd isolerad från cyanobakterien Lyngbya majuscula . Curacin A tillhör en familj av naturliga produkter inklusive jamaicamid, mupirocin och pederin som har en ovanlig terminal alken . Dessutom innehåller Curacin A en anmärkningsvärd tiazolinring och en unik cyklopropyldel , som är väsentlig för föreningens biologiska aktivitet . Curacin A har karakteriserats som potent antiproliferativ cytotoxisk förening med anmärkningsvärd anticanceraktivitet för flera cancerlinjer inklusive njur-, kolon- och bröstcancer. Curacin A har visat sig interagera med kolchicinbindningsställen på tubulin, vilket hämmar mikrotubulipolymerisation, en viktig process för celldelning och proliferation.
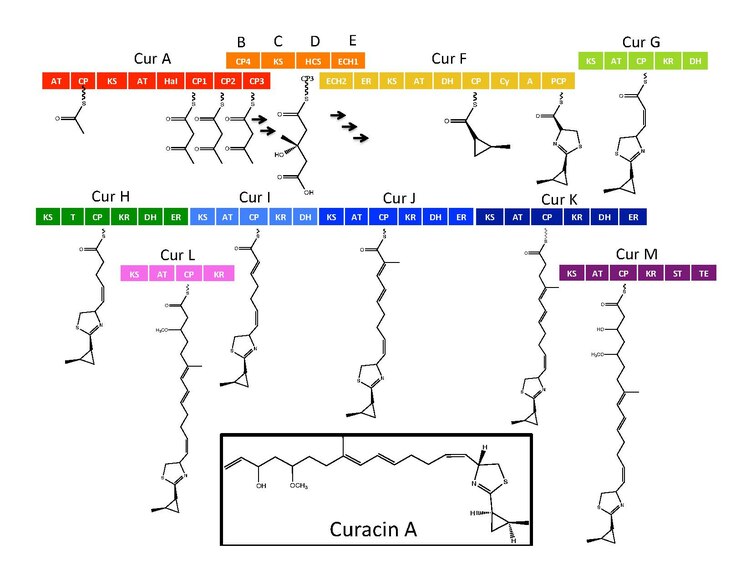
Biosyntes
De syntetiska enzymerna för Curacin A finns i ett genkluster med 14 öppna läsramar (ORF) med nomenklaturen CurA till CurN. Analys av vägen visade närvaron av en NRPS/PKS-hybridmodul belägen på CurF, en HMG-CoA- syntaskassett belägen på CurD, och sju monomodulära PKS-moduler. CurA innehåller en unik GCN5-relaterad N -acetyltransferas (GNAT) laddningsdomän och ett associerat acylbärarprotein (ACP). Laddningsmodulen binder en acetylgrupp till ACP som sedan kondenserar med en av tre tandem ACP som finns i den intilliggande modulen i CurA. En hydroximetylglutaryl-CoA-syntaskassett (mevalonatväg) katalyserar bildningen av hydroximetylglutarylsyra genom tillsats av en malonyl-CoA-enhet till den terminala ketiden av aceto-acetyl-ACP-delen av ACP1, ACP2 eller ACP3. efterföljande enzymer, inklusive ett unikt hemoberoende halogenas (Hal), katalyserar bildningen av en cyklopropylring. En cysteinspecifik NRPS-modul belägen på CurF följer efter cyklopropylringbildning och bildar på grund av aktiviteten hos en cykliserande kondensationsdomän en tiazolring fäst till cyklopropyldelen från tidigare reaktioner i vägen. Sju fristående PKS-moduler följer för att förlänga den växande polyketidkedjan med S -adenosylmetionin (SAM)-beroende metyleringar som sker vid positionerna 10 och 13. En sällsynt avlastningsstrategi som involverar ett sulfotransferas används av den slutliga curacinsyntasmodulen. Sulfotransferaset sulfaterar hydroxylgruppen i kol 15, vilket aktiverar molekylen för dekarboxylering och terminal alkenbildning.
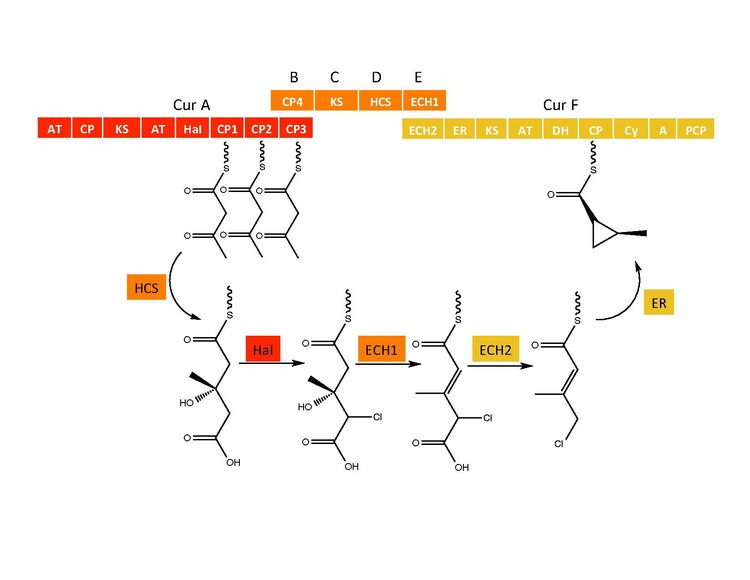
Cyklopropylringbildning
CurB (ACP), CurC (ketosyntas) och CurD (HMG-CoA-reduktas) är ansvariga för bildningen av (S)HMG-ACP3. HaI, från CurA-genen, är ett unikt icke-hem-halogenas som går genom en påstådd Fe(IV)=O-mellanprodukt för att lägga till en kloratom till en oaktiverad kolatom. Efter klorering dehydratiserar ECH1 HMG-ACP3 till 3-metylgultakonyl-ACP3 och ECH2 utför den erforderliga dekarboxyleringen. Slutligen bildar en ovanlig ER-katalyserad cykliseringsreaktion, som påstås gå igenom en substitutionsliknande mekanism, cyklopropanringen. Den tillsatta kloratomen hjälper till i dekarboxyleringssteget och tjänar sannolikt som den lämnande gruppen under bildning av cyklopropanring.