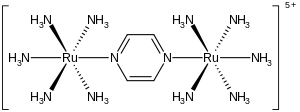
Creutz–Taube komplex
Creutz –Taube-jonen är metallkomplexet med formeln {[ Ru ( NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 5+ . Denna katjoniska art har studerats hårt i ett försök att förstå de intima detaljerna av elektronöverföring i den inre sfären, det vill säga hur elektroner rör sig från ett metallkomplex till ett annat. Jonen är uppkallad efter Carol Creutz, som först förberedde komplexet, och hennes avhandlingsrådgivare Henry Taube , som fick ett Nobelpris i kemi för detta och relaterade upptäckter om elektronöverföring.
Egenskaper
Komplexet består av två pentaminruteniumenheter kopplade till kväveatomerna i en överbryggande pyrazinligand , som kompletterar den oktaedriska koordinationssfären för varje metall . Den viktiga egenskapen hos föreningen är att de två metallerna har uppenbara fraktionerade oxidationstillstånd på +2,5. Normalt har metalljoner, som de flesta joner, heltalsoxidationstillstånd. Till exempel är ruteniumaminkomplex typiskt +2 eller +3. Det faktum att oxidationstillstånden är ett halvt heltal indikerar att de två Ru(NH 3 ) 5- centran är ekvivalenta vad gäller antalet elektroner. Kristallografiska och teoretiska studier överensstämmer med denna beskrivning, det vill säga att de två metallcentra är likvärdiga. Karakteristiskt för ett blandat valenskomplex absorberar denna jon starkt ljus i den nära-infraröda delen av det elektromagnetiska spektrumet . När det gäller Creutz–Taube-jonen inträffar absorptionsmaximum vid 1570 nm . Denna absorption beskrivs som ett intervalensladdningsöverföringsband .
Syntes
Jonen isolerades ursprungligen som det hydratiserade tosylatsaltet [Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 ) (O 3 SC 6 H 4 CH 3 ) 5 · 3H 2 O. Den framställs i två steg via Ru(III)-Ru(III)-pyrazinkomplexet:.
- 2 [Ru(NH 3 ) 5 Cl] 2+ + C 4 H 4 N 2 → {[Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 6+ + 2 Cl −
- 2 {[Ru( NH3 ) 5 ] 2 ( C4H4N2 ) } 6+ + Zn → 2 { Ru ( NH3 ) 5 ] 2 ( C4H4N2 ) } 5+ + Zn2 +
Creutz-Taube-jonen illustrerar fördelarna med ruteniumkomplex för att undersöka redoxreaktioner. Ru(II)- och Ru(III)-joner kan interkonverteras vid milda redoxpotentialer . Båda dessa oxidationstillstånd är kinetiskt inerta. Många analoger av denna jon har framställts med användning av olika överbryggande ligander.