Cadherin-catenin komplex i inlärning och minne
Långsiktig potentiering (LTP), som anses vara den cellulära basen för inlärning och minne, involverar en specifik signalöverföringsprocess som ligger till grund för synaptisk plasticitet. Bland de många mekanismerna som är ansvariga för upprätthållandet av synaptisk plasticitet är cadherin - catenin -komplexet. Genom att bilda komplex med intracellulära kateninproteiner fungerar neurala cadheriner ( N-cadheriner ) som en länk mellan synaptisk aktivitet och synaptisk plasticitet och spelar viktiga roller i processerna för inlärning och minne.
N-cadheriner tros vara involverade i att förmedla LTP och de synaptiska förändringarna som ligger bakom inlärning och minne. Under embryonal utveckling cadheriner initialt brett distribuerade, men de blir gradvis mer lokaliserade till pre- och postsynaptiska platser medan synapser bildas. Blockering av cadherinfunktion med specifika proteiner påverkar inte basala synaptiska egenskaper, men det kan försämra induktionen av LTP.
Strukturell funktion och vidhäftning
Strukturen av cadherin-catenin-komplexet
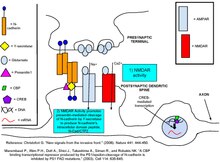
N-cadheriner är transmembranproteiner som uttrycks i majoriteten av CNS-synapser. N-cadheriner uttrycks oftast på både den presynaptiska aktiva zonen och postsynaptisk densitet (PSD)-regioner och innehåller både extracellulära Ca2+-bindande domäner såväl som intracellulära domäner för att binda deras proteinpartners. En vanlig bindningspartner för cadheriner är intracellulära kateninproteiner, specifikt de tre olika subtyperna, α-cateniner, β-cateniner och p120ctn familjens kateniner. β-cateniner och p120ctns binder cadherins intracellulära domän vid de distala respektive proximala regionerna. a-cateniner, när de är i monomer form, kommer att associeras med cadherin-catenin-komplexet via β-cateniner. I homodimer form binder a-cateniner inte β-cateniner, utan binder företrädesvis F-aktin och andra proteiner som främjar F-aktin-polymerisation. Varje cateninsubtyp och dess interaktion med cadheriner spelar en distinkt roll i förmedlingen av synaptisk plasticitet och ryggradsstruktur.
Reglering av vidhäftning
Bevis tyder på att N-Cadheriner stabiliserar kopplingen mellan den presynaptiska terminalen och den postsynaptiska ryggraden och att denna stabilisering ökar sannolikheten för att frisatt glutamat kommer att binda receptorer på den postsynaptiska neuronen. Vid basala nivåer av synaptisk aktivitet är N-cadheriner till stor del monomerer och är således svagt vidhäftande till cadheriner som finns i cellen på motsatt sida av synapsen. Inflödet av Ca2+ genom NMDAR främjar dimeriseringen av N-cadheriner. Dimeriserade cadheriner binder lätt till sina presynaptiska cadherinpartners. Hämning av N-cadherin-bindning via blockerande antikroppar förhindrar induktionen av L-långtidspotentiering i sen fas, vilket tyder på att den adhesiva egenskapen hos dimert N-cadherin är nödvändig för L-LTP i sen fas. Dessutom ger KCl-depolarisering av det presynaptiska axonet både proteasresistens mot N-cadheriner och sprider dem genom PSD från deras ursprungliga klustring i synaptiska puncta, vilket ökar deras effektivitet för celladhesion.
N-cadherinadhesion stabiliserar synapsen ytterligare genom att möjliggöra AMPAR-aktiveringsinducerad ryggradsexpansion. Denna morfologiska förändring hjälper till att förhindra ytterligare synaptiska modifieringar som kan äventyra informationen som innehas av de redan existerande synaptiska anslutningarna. Expansion av ryggradshuvudet åstadkommer detta genom att minska NMDAR till AMPAR-förhållandet, vilket skapar ett proportionellt mindre kalciuminflöde, samt genom att möjliggöra snabbare kalciumdiffusion ut ur ryggraden. Det snabba avlägsnandet av kalcium hindrar det från att initiera de posttranslationella modifieringarna som ytterligare skulle förändra den synaptiska styrkan. Överuttryck av en N-cadherinmutant som inte kan vidhäfta förhindrar ryggradsexpansion, vilket visar N-cadherins väsentliga roll i denna process.
Reglering av cadherin ytnivåer, omsättning och stabilitet
Regleringsmekanismer skiljer sig åt i sina synteskrav och deras tidsmässiga initiering. Ett sätt att reglera kadherin är ytstabilisering, en ganska snabb process (som inträffar cirka 100 minuter efter aktivitet) som är oberoende av proteinsyntes.
NMDAR-aktivitet minskar fosforylering av β-catenin vid tyr-654, vilket hämmar N-cadherin- endocytos och underlättar ytretention och uttryck.
Ytuttryck regleras också via protokadherin- medierad adhesion. Protocadherin-alfa och protocadherin-gamma interagerar för att bilda ett proteinkomplex som förbättrar ytuttrycket av varje cadherinsubtyp.
Cadherin-uttrycket regleras också av aktivitetsinducerad internalisering, som sker mycket senare än ytstabilisering (i genomsnitt 4 timmar efter stimulansen). Internalisering är beroende av proteinsyntes, och p120 kateninproteiner (p120ctn) är inblandade i omsättningen, nedbrytningen och "klustringen" av cadheriner i de adhesiva förbindelserna vid synapsen. P120 ctn-proteiner tros antingen hämma endocytos av neurala cadheriner eller verka på cellytan för att kontrollera cadherinomsättningen. Nedreglering av p120 ctn leder till större cadherinendocytos och förhindrar vidhäftning mellan den pre- och postsynaptiska neuronen. Sådana bevis tyder starkt på att p120 är nödvändigt för cadherinstabilitet.
Bindning och signalering
Intracellulära bindningspartners
β-catenin lokaliserar reservpoolvesiklar (RPV) vid presynaptiska platser. Borttagningen av β-catenin in vivo resulterar i en minskning av antalet RPV lokaliserade i det synaptiska stället och en ökning av RPV spridda längs axonet. Dessutom svarade RPV inte på kontinuerliga stimuleringståg av den presynaptiska neuronen i B-catenin-knockouts. Denna effekt av B-catenin är oberoende av cadherin-medierad adhesion, och moduleras istället av PDZ-bindande proteiner såsom Veli till cadherin. Dessutom BDNF / TrkB -signalering till fosforylering av β-catenin vid dess Y654-ställe, vilket gör att β-catenin-cadherin-komplexet löses upp och följaktligen ökar synaptisk vesikelrörlighet. Kateniner binder även många byggnadsställningars proteiner, receptorer, kinaser och fosfataser. Till exempel binder cadherin-a-catenin-komplexet aktincytoskelettet, även om det binder via bindande proteiner eller direkta interaktioner är okänt.
Signaltransduktionsvägar
p120ctn signalerar genom guanin-nukleotidutbytesfaktorer (GEFs) och GAPs för att aktivera Rho-familjen av GTPaser . RhoA måste hämmas av P120ctn för att bibehålla ryggradens täthet och längd. Rac (GTPase) -hämning åtgärdar en minskning av ryggradsdensiteten vid p120ctn-brist. E-cadherinbindning till p120ctn kan aktivera SRC vilket leder till aktivering av Rac1 vilket resulterar i fosforylering av LIMK1 och LIMK2 för att deaktivera cofilin som orsakar G-aktinpolymerisation. Samtidigt aktiverar fosforylering av PI3K av SRC RhoA vilket leder till aktivering av cofilin-P och störning av filamentöst aktin. När WAVE-1-genen stördes i möss, resulterade det i kognitiva defekter såsom förluster i inlärning och minne som implicerade WAVE-1-grenen av Rac-vägen. Med hjälp av en in vivo dentate gyrus LTP-modell visades det att LTP-induktion är associerad med en ökning av F- aktin i dendritiska ryggraden, och detta är en långvarig förändring. Det visades att NMDA-receptoraktivering krävs för denna effekt. kunde användningen av latrunkulin A försämra LTP i sen fas i denna modell, vilket återigen antyder att aktin-ombyggnad är nödvändig för LTP.
Cellulär funktion
Roll i receptorhandel/stabilitet
När det glutamatreceptorbindande proteinet ABP och p120ctn samuttrycks, drar anti-p120ctn-serum ut ett komplex som innehåller båda proteinerna från cellysat. Detsamma gäller för ett protein som liknar ABP, kallat GRIP. cDNA-screening och jästparningsanalyser visar att det PDZ-domänbindande motivet vid p120ctn C-terminalen möjliggör sådana interaktioner. Co-IP- data visar att p120ctn samtidigt kan komplexa med cadherin och antingen ABP eller GRIP. Dominanta negativa p120ctn-fragment, som misslyckades med att interagera med ABP och GRIP, försämrade stabiliseringen av GluR2- respektive GluR3 AMPAR-subenheter vid plasmamembranet . Samlokalisering av p120ctn med PSD-95 tyder på att cadherin-p120ctn-ABP/GRIP-komplex förankrar AMPAR vid den postsynaptiska densiteten , men det är oklart om förankring också sker vid perisynaptiska platser.
Reglering av genuttryck
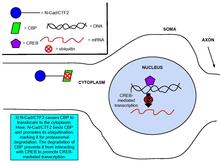
Cadheriner och kateniner har visat sig vara involverade i reglering av genuttryck, en viktig process i synaptisk plasticitet. Glutamatbindning till NMDA uppreglerar produktionen av N-cadherins intracellulära domänpeptid, N-cad/CTF2, en effekt som blockeras av NMDA- receptorantagonisten , APV. Transfektion av N-cad/CTF2 minskar nukleärt CBP ( CREB-bindande protein ) och ökar cytosoliskt CBP. Vidare samimmunoutfälls N-cad/CTF2 med CBP, och transfektion av N-cad/CTF2 minskar CBP-steady state-nivåerna, vilket följaktligen försämrar CREB -innehållande DNA -komplexbildning (se figurerna till höger).
Uttryck av lymfoid förstärkarbindande faktor 1 (LEF-1) utlöser translokationen av β-catenin till kärnan , där det uppreglerar transkriptionen, och transfektion av N-cadherin eller α-catenin reverserar denna effekt. Dessutom orsakar behandling av neuroner med NMDAR- agonist klyvning av β-catenin N-terminalen , och de C-terminala fragmenten translokeras till kärnan, där, som transfektionsexperiment visar, β-catenin ökar T-cellfaktor (TCF) beroende transkription.