CSNK1D
| CSNK1D | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , ASPS, CKIdelta, FASPS2, HCKID, kaseinkinas 1 delta, CKId, CKI-delta | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID | |||||||||||||||||||||||||||||||||||||||||||||||
| :n EC-nummer | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Kaseinkinas I isoform delta även känd som CKI-delta eller CK1δ är ett enzym som hos människor kodas av genen CSNK1D , som finns på kromosom 17 (17q25.3). Det är en medlem av CK1 -familjen (tidigare kallad kaseinkinas 1) av serin/treoninspecifika eukaryota proteinkinaser som omfattar sju distinkta isoformer (CK1α, γ1-3, δ, ε) såväl som olika post-transkriptionellt bearbetade splitsningsvarianter (transkriptionsvarianter). varianter, TV-apparater) hos däggdjur . Samtidigt har CK1δ-homologa proteiner isolerats från organismer som jäst , basidiomyceter , växter , alger och protozoer .
Genetisk kodning
1993 beskrevs gensekvensen för CK1δ initialt av Graves et al. som isolerade cDNA från testiklar från råttor. Efter sekvensering och karakterisering av genen beskrevs konstruktionen som en 1284 nukleotidsekvens resulterande i ett protein bestående av 428 aminosyror efter transkription. Molekylvikten för det motsvarande proteinet publicerades som 49 kDa. Tre år senare identifierades samma gen hos människor. Den mänskliga CSNK1D innehåller 1245 nukleotider och transkriberas till ett protein som består av 415 aminosyror.
Ända sedan dess har CK1δ undersökts och beskrivits i olika djur, växter, såväl som parasiter ( Caenorhabditis elegans , 1998; Drosophila melanogaster , 1998; Mus musculus , 2002; Xenopus laevis , 2002.)
Transkriptionsvarianter
Hittills har tre olika transkriptionsvarianter (TV) beskrivits för CK1δ hos människor ( Homo sapiens ), möss ( Mus musculus ) och råttor ( Rattus norvegicus ), som är mycket homologa. Justeringen av alla CK15-sekvenser för alla organismer visar en hög homologi i de första 399 aminosyrorna, förutom position 381. Medan de humana transkriptionsvarianterna använder isoleucin, innehåller mus- och råttsekvenserna en valin istället. Det enda undantaget är rått-TV3, som också transkriberar sin nukleotidsekvens till en isoleucin.
Efter position 399 kan tre olika allmänna strukturer observeras. Den första varianten består av 415 aminosyror över alla tre organismerna och kallas TV1 hos människa och råtta, medan den murina motsvarigheten heter CRAa. Den kortaste gruppen av sekvenser består av 409 aminosyror: TV2 hos människor och råttor, CRAc hos möss. Den längsta varianten består av 428 aminosyror i råtta (TV3) och möss (CRAb), medan den mänskliga (TV3) varianten saknar den näst sista aminosyran (treonin), vilket resulterar i ett protein med en längd på 427 aminosyror.
De olika transkriptionsvarianterna är baserade på en annan användning av exonerna som kodar för CSNK1D . Hela genen består av elva olika exoner och finns hos människor på kromosom 17 i position 17q25.3. CSNK1D har en längd på 35 kb och överlappar genen Slc16a3 . Den korsande delen är exon 11, som ligger nedströms exon 10. Den stör dock inte Slc16a3 eftersom den är belägen i ett icke-kodande område.
TV1 och TV2 postulerades under en tidig analys av mänskliga och murina gener 2002. Båda transkriptionsvarianterna delar de första 399 aminosyrorna, men skiljer sig vid följande 16 aminosyror för TV1 respektive tio aminosyror för TV2. Detta är kopplat till exon-användningen. Medan de delar de första åtta exonerna använder TV1 exon 10 och TV2 exon 9 för att avsluta sin respektive sekvens. Den tredje transkriptionsvarianten postulerades efter en databanksanalys år 2014. Den föreslagna sekvensen delar de första 399 aminosyrorna med TV1 och TV2, men skiljer sig i de kommande 28 aminosyrorna. Exonanvändningen av TV3 består av exon 1 till 8, som följs av exon 11 för att avsluta sekvensen.
Förutom olika sekvenser av de tre olika transkriptionsvarianterna, visar varianterna även skillnader i Michaelis-Menten kinetiska parametrar (Km och Vmax ) med avseende på deras potential att fosforylera kanoniskt (α-kasein) såväl som icke-kanoniskt (GST- β-catenin 1-181 ) substrat (Xu et al., 2019). TV3 visar en ökning av fosforylering av båda substraten jämfört med TV1 och TV2, vilket är statistiskt signifikant. Dessa skillnader kan förklaras av olika grader av autofosforylering av transkriptionsvarianterna.
Polyadenylering
Baserat på mjukvaruanalys av mRNA-sekvenserna kunde olika polyadenyleringsmönster identifieras för transkriptionsvarianterna. TV1 och TV2 delar samma mönster lokaliserat på exon 10 med början vid position 1246 vilket resulterar i ett 32 nukleotiders motiv (AGUAGAGUCUGCGCUGUGACCUUCUGUUGGGC). TV3 använder ett motiv på exon 11 vid position 320. Motivet är också 32 nukleotider långt, men skiljer sig från sekvensen som används av TV1/2 (AGUGGCUUGUUCCACCUCAGCUCCCAUCUAAC). Skillnaden i polyadenyleringssekvensen resulterar i en varians av de minsta fria energivärdena för de förutsagda RNA-vikningsstrukturerna (-28,70 kcal/mol, TV1 och TV2 och -16,03 kcal/mol, TV3), vilket kan resultera i olika längder av Poly-A svans. Baserat på observationen att stabila sekundära strukturer resulterar i minskad polyadenylering av den specifika platsen, kan detta indikera att TV1 och TV2 är mindre polyadenylerade jämfört med TV3.
Strukturera

Liksom eukaryota proteinkinaser (ePK) består de olika isoformerna av CK1- familjen av en N-terminal och en C-terminal lob (N- respektive C-lob), som är sammankopplade via en gångjärnsregion. Medan N-loben huvudsakligen består av β-arksträngar, består den större C-loben övervägande av a-helix- och loopstrukturer. Mellan båda loberna bildas en katalytisk klyfta, som rymmer substrat och ATP för kinasreaktionen.
Bindning av substrat och samsubstrat
Bindning av fosforylerade substrat till distinkta regioner av C-loben har tidigare detekterats genom bindning av ett volframatderivat (som en fosfatanalog). Istället för fosfo-primat substrat kan också den C-terminala regulatoriska domänen av CK1δ binda till denna position i syfte att få autoregulatorisk funktion. Bindning av ATP förmedlas huvudsakligen via den glycinrika P-loopen (L-12, överbryggande strängar β1 och β2), som bildar det övre höljet på WTP-bindningsstället, och den så kallade katalytiska slingan (L-67). Konformationsförändringar som påverkar aktiveringsslingan (L-9D) är relaterade till reglering av kinasaktivitet. När aktiveringsslingan rör sig ut från det katalytiska stället skiftar det katalytiskt relevanta DFG-motivet (Asp-149, Phe-150 och Gly-151) till en intern position. Aspartatåterstoden kelerar en Mg 2+ -jon vilket tillåter korrekt bindning och orientering av ATP. En annan rest, som huvudsakligen är involverad i regleringen av kinasaktivitet, men också i att bilda interaktioner med småmolekylära hämmare, är Met-82, den så kallade gatekeeper-resten. Direkt placerad i ATP-bindningsfickan kontrollerar denna rest åtkomst av små molekyler till vissa bindningsfickor (selektivitetsfickor) placerade bortom portvaktens position.
Ytterligare funktionella domäner
Förutom domäner som är direkt involverade i katalytisk aktivitet finns ytterligare funktionella domäner närvarande i CK15-proteinet. En kinesinhomologidomän (KHD) såväl som en förmodad dimeriseringsdomän (DD) kan hittas i kinasdomänen. Medan KHD tillåter CK1- isoformer att interagera med komponenter i cytoskelettet. DD antas vara involverad i reglering av kinasaktivitet (se nedan). I C-loben kan dessutom en nukleär lokaliseringssignal (NLS) samt en centrosomlokaliseringssignal (CLS) hittas. Den första är dock inte tillräcklig för att lokalisera CK1δ till kärnan.
Reglering av uttryck och aktivitet
Rigorös kontroll av CK1δ-uttryck och kinasaktivitet är avgörande på grund av dess inblandning i viktiga cellulära signaltransduktionsvägar. Generellt sett skiljer sig basala uttrycksnivåer av CK1δ mellan olika vävnader, celltyper och fysiologiska omständigheter. Ökade uttrycksnivåer av CK1δ-mRNA kan detekteras efter behandling av celler med DNA-skadande substanser, som etoposid och kamptotecin, eller genom y-bestrålning, medan ökad CK1-specifik aktivitet observeras efter stimulering av celler med insulin eller efter viral transformation.
Subcellulär sekvestrering
På proteinnivå kan CK1δ-aktivitet regleras genom sekvestrering till särskilda subcellulära avdelningar som för samman kinaset med distinkta pooler av substrat för att styra dess cellulära funktion. Denna sekvestrering underlättas vanligtvis av byggnadsställningsproteiner, som också är tänkta att allosteriskt kontrollera aktiviteten hos det interagerande kinaset. För CK1δ har subcellulär sekvestrering beskrivits förmedlas av A-kinasankarprotein (AKAP) 450, det X-länkade DEAD-box RNA helicase 3 (DDX3X), kaseinkinas-1 bindande protein (CK1BP) och det regulatoriska och komplexa -byggande/-initierande molekyl 14-3-3 ζ. AKAP450 rekryterar CK1δ och ε till centrosomen för att utöva centrosomspecifika funktioner i samband med cellcykelreglering. DDX3X främjar CK1ε-medierad fosforylering av Disheveled (Dvl) i den kanoniska Wnt-vägen men har också visat sig stimulera CK1δ- och ε-specifik kinasaktivitet med upp till fem storleksordningar. Tvärtom kan proteiner som är homologa med CK1BP (t.ex. dysbindin eller BLOC-1 [biogenes av lysosomrelaterade organeller komplex-1]) hämma CK1δ-kinasaktivitet på ett dosberoende sätt.
Dimerisering
Dimerisering av CK1δ har också beskrivits som en reglerande mekanism genom interaktionsgränssnittet som finns i DD av CK1δ. Efter dimerisering sätts Arg-13 in i adeninbindningsfickan och förhindrar bindning av ATP och kanske även av stora substrat. Även om CK1δ i lösning alltid renas som monomerer, kunde biologisk relevans av dimerisering demonstreras genom att visa att bindningen av dominant-negativ mutant CK1δ till vildtyp CK1δ resulterade i den totala minskningen av CK1δ-specifik kinasaktivitet.
Platsspecifik fosforylering

Posttranslationella modifieringar, särskilt platsspecifik fosforylering medierad antingen av uppströms kinaser eller genom intramolekylär autofosforylering, har visats reversibelt modulera CK1δ kinasaktivitet. Flera rester inom den C-terminala regulatoriska domänen av CK1δ identifierades som mål för autofosforylering, inklusive Ser-318, Thr-323, Ser-328, Thr-329, Ser-331 och Thr-337. Vid autofosforylering genereras sekvensmotiv inom den C-terminala domänen, som kan blockera kinasets katalytiska centrum genom att fungera som ett pseudosubstrat. Regulatorisk funktion av den C-terminala domänen har vidare bekräftats av observationen att kinasaktiviteten ökar efter proteolytisk klyvning av denna domän.
Förutom autofosforylering har platsspecifik fosforylering av andra cellulära kinaser visats reglera kinasaktivitet. Hittills har C-terminal fosforylering av CK1δ av uppströms kinaser bekräftats för proteinkinas A (PKA), proteinkinas B (Akt), cyklinberoende kinas 2/cyklin E (CDK2/E) och cyklinberoende kinas 5/ p35 (CDK5/p35), CDC-liknande kinas 2 (CLK2), proteinkinas Ca (PKCa) och kontrollpunktkinas 1 (Chk1). För flera fosforyleringshändelser har även effekter på kinasfunktion beskrivits. För rest Ser-370, som kan fosforyleras åtminstone av PKA, Akt, CLK2, PKCα och Chk1, har en viktig regulatorisk funktion visats. Som en konsekvens av förändrad kinasaktivitet hos en CK1δ S370A-mutant, resulterade senare påverkad Wnt/β-catenin-signaltransduktion i utveckling av en ektopisk ryggaxel i Xenopus laevis- embryon. Ytterligare rester som målsöks av platsspecifik fosforylering visas i figur 2. Mutation av identifierade målställen till den icke-posforylerbara aminosyran alanin leder till signifikanta effekter på katalytiska parametrar för CK1δ i de flesta fall, åtminstone in vitro .
Bevis genererades också i cellodlingsbaserade analyser, som visar minskad CK1-specifik kinasaktivitet efter aktivering av cellulär Chk1, och ökad aktivitet av CK1 efter behandling av celler med den PKC-specifika hämmaren Gö-6983 eller pan-CDK-hämmaren dinaciclib . Dessa fynd indikerar att platsspecifik fosforylering medierad av Chk1, PKCa och CDK faktiskt resulterar i minskad cellulär CK1-specifik kinasaktivitet. Men robusta in vivo fosforyleringsdata saknas i de flesta fall och biologisk relevans och funktionella konsekvenser av platsspecifik fosforylering återstår att undersöka för in vivo- förhållanden. Dessutom har fosforyleringsmålställen inom kinasdomänen inte karakteriserats i stor omfattning ännu och är föremål för framtida forskning.
Substrat
Hittills har mer än 150 proteiner identifierats som mål för CK1-medierad fosforylering, åtminstone in vitro . Fosforylering av många substrat är möjlig på grund av förekomsten av flera konsensusmotiv, som kan kännas igen av CK1 -isoformer.
Kanoniskt konsensusmotiv
CK15 interagerar företrädesvis med fosfo-primade eller sura substrat på grund av lokaliseringen av positivt laddade aminosyror (t.ex. Arg-178 och Lys-224) i regionen involverad i substratigenkänning. Det kanoniska konsensusmotivet som CK1 riktar sig mot representeras av sekvensen pSer/pThr-XX-(X)-Ser/Thr. I detta motiv står X för vilken aminosyra som helst medan pSer/pThr indikerar en tidigare fosforylerad serin- eller treoninrest. CK1-medierad fosforylering sker vid Ser/Thr nedströms om den fosfo-primade resten. Men istället för en primerad rest kan också ett kluster av negativt laddade aminosyrarester (Asp eller Glu) inkluderas i det kanoniska konsensusmotivet.
Icke-kanoniskt konsensusmotiv
Som ett första icke-kanoniskt konsensusmotiv riktat mot CK1δ har det så kallade SLS-motivet (Ser-Leu-Ser) beskrivits, vilket kan hittas i β-catenin och nukleär faktor av aktiverade T-celler (NFAT). I flera sulfatid- och kolesterol-3-sulfat (SCS)-bindande proteiner har konsensusmotivet Lys/Arg-X-Lys/Arg-XX-Ser/Thr identifierats och fosforylering av detta motiv har påvisats för myelinbasprotein (MBP) Ras-homolog familjemedlem A (RhoA) och tau.
Subcellulär lokalisering
Inom levande celler kan CK1δ detekteras i båda, cytoplasman och kärnan, och ökade nivåer av CK1δ kan hittas i nära anslutning till Golgi-apparaten och trans Golgi-nätverket (TGN). Tillfälligt kan CK1δ också lokaliseras till membran, receptorer, transportvesiklar, komponenter i cytoskelettet, centrosomer eller spindelpoler. Även om föreliggande NLS inte är tillräckligt för nukleär lokalisering av CK1δ, behövs närvaron av kinasdomänen och till och med dess enzymatiska aktivitet för korrekt subcellulär lokalisering av CK1δ.
Interaktion med cellulära proteiner
Lokalisering av CK1δ till vissa subcellulära avdelningar kan vidare initieras genom dess interaktion med cellulära proteiner. För att förmedla interaktion med CK1δ måste lämpliga dockningsmotiv finnas i respektive proteiner. Dockningsmotiv Phe-XXX-Phe har identifierats i NFAT, β-catenin, PER och proteiner från FAM83-familjen. Som ett exempel kan nukleär CK1δ lokaliseras till nukleära prickar genom dess interaktion med FAM83H. Ett annat interaktionsmotiv representeras av sekvensen Ser-Gln-Ile-Pro, som finns i mikrotubuli plus-änd-bindande protein 1 (EB1). Många interaktionspartners för CK1δ har beskrivits under de senaste åren, som bildar starka interaktioner med CK1δ och är därför mer än enkla substratproteiner. Som nämnts ovan har interaktioner med CK1δ visats för AKAP450 och DDX3X. Genom att initialt utföra tvåhybridscreeningar av jäst, kunde interaktionen också bekräftas för det Ran-bindande proteinet i det mikrotubuli-organiserande centret (RanBPM), mikrotubuli-associerat protein 1A och snapin, ett protein associerat med neurotransmittorfrisättning i neuronala celler. Interaktioner med CK1δ har också upptäckts för de utvecklingsassocierade faktorerna LEF-1 (lymfocytförstärkarfaktor-1) och den proneurala basala helix-loop-helix (bHLH) transkriptionsfaktorn Atoh1. Slutligen har interaktion av CK1δ med PER och CRY dygnsrytmklockproteiner visats, vilket underlättar nukleär translokation av PERs och CRYs.
Cellulära funktioner
Dygnsrytm
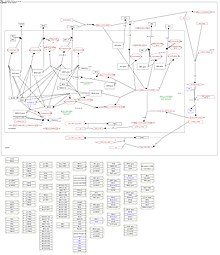
CK1δ verkar vara involverad i dygnsrytmen, den interna cellulära klockan, som tillåter en rytm på cirka 24 timmar. Dygnsrytmen består huvudsakligen av en negativ återkopplingsslinga som medieras av (PER) och kryptokrom (CRY) proteiner, som kan dimerisera och skjuta in i kärnan. Här kan PER/CRY-dimerer hämma sin egen transkription, genom att hämma den CLOCK/BMAL1-responsiva gentranskriptionen. Förändring av normal dygnsrytm har observerats vid olika sjukdomar, bland annat neurologiska och sömnstörningar. I kärnan kan CK1δ ytterligare hämma CLOCK/BMAL1-driven transkription genom att minska deras bindningsaktivitet till DNA. Dessutom kan CK1δ/ε fosforylera PER-proteiner och påverka deras ytterligare nedbrytning. Destabilisering av dygnsrytmen kan observeras efter hämning av PER-fosforylering av CK1δ/ε. Faktum är att förändringar i CK1δ-aktivitet leder till förändringar i längden på dygnsrytmen.
DNA-skador och cellulär stress
CK1δ kan också aktiveras av genotoxisk stress och DNA-skada på ett p53-beroende sätt, och fosforylera viktiga regulatoriska proteiner som svar på dessa processer. CK15 fosforylerar humant p53 på Ser-6, Ser-9 och Ser-20. Dessutom fosforylerar CK1δ p53 på Thr-18, när p53 redan är fosfo-primad, vilket tillåter en lägre p53-Mdm2-bindning och högre p53-aktivitet. Under normala förhållanden kan CK1δ fosforylera Mdm2 på Ser-240, Ser-242, Ser-246 och Ser-383, vilket tillåter högre p53-Mdm2-stabilitet och ytterligare p53-nedbrytning. Tvärtom, efter DNA-skada, fosforylerar ATM CK1δ, vilket därefter kan fosforylera Mdm2 och inducera dess proteasomala nedbrytning. Under hypoxi är CK1δ involverad i att minska cellproliferation genom att störa HIF-1α/ARNT-komplexbildning. Dessutom ökade aktiviteten av topoisomeras II α (TOPOII-α), en av de viktigaste regulatorerna av DNA-replikation, efter dess CK1δ-medierade fosforylering på Ser-1106. Under stressförhållanden kan CK1δ störa DNA-replikation. Faktum är att CK1δ fosforylerar en huvudregulator av DNA-metylering, det ubiquitin-liknande innehållande PHD och RING finger domäner 1 protein (UHRF1), på Ser-108, vilket ökar dess proteasomala nedbrytning.
Cellcykel, mitos och meios
CK1δ är involverad i mikrotubulidynamik, cellcykelprogression, genomisk stabilitet, mitos och meios. Övergående mitotiskt stopp, kan observeras efter CK1δ-hämning med IC261, även om denna hämmare nyligen har visat sig inte vara CK1-specifik och ha många ytterligare off-target. I linje med dessa resultat tillåter CK1δ-hämning eller tystnad Wee1- stabilitet . och efterföljande Cdk1-fosforylering som tillåter cellcykelutträde. Frånvaro av CK1δ har också associerats med genomisk instabilitet. Ändå är CK1δs roll i mitos fortfarande oklar och motsatta rapporter har publicerats.
CK1δ verkar också vara involverad i meios. Hrr25, CK1δ-ortologen i Saccharomyces cerevisiae , kan hittas lokaliserad till P-kroppar – RNA/proteingranuler identifierade i cytoplasman hos meiotiska celler – och verkar vara nödvändig för progression av meios. Dessutom observerades Hrr25 ha en roll i kärndelning och membransyntes under meios II. I Schizosaccharomyces pombe främjar CK1δ/ε-ortologen Hhp2 klyvningen av kohesionsproteinet Rec8 möjligen efter dess fosforylering under meios. Dessutom kunde fosforylering av STAG3, däggdjursortologen av Rec11, av CK1 också observeras, vilket bekräftar en möjlig bevarande av denna process även hos däggdjur.
Cytoskelett associerade funktioner
CK1δ är involverad i regleringen av mikrotubuluspolymerisation och stabilitet hos spindelapparaten och centrosomerna under mitos genom att direkt fosforylera α-, β- och γ-tubulin. Dessutom kan CK1δ också fosforylera mikrotubuli-associerade proteiner (MAP) och därigenom påverka deras interaktion med mikrotubuli såväl som mikrotubuli-dynamik.
Utvecklingsvägar

CK1δ är involverad i olika utvecklingsvägar, bland dem Wingless (Wnt)-, Hedgehog (Hh)- och Hippo (Hpo)-vägar. I Wnt-vägen kan CK1δ fosforylera olika faktorer i vägen, bland dem Disheveled (Dvl), Axin, APC och β-catenin. CK1δ påverkar också negativt stabiliteten av β-catenin, efter dess fosforylering på Ser-45, vilket tillåter GSK3β-medierade ytterligare fosforyleringar och efterföljande nedbrytning.

I Hh-vägen kan CK1δ fosforylera Smothened (Smo) och därigenom förbättra dess aktivitet. Dessutom är dess ytterligare roll i dessa signalvägar fortfarande kontroversiell. Faktum är att å ena sidan kan CK1δ fosforylera Cubitus interruptus activator (CiA) och därigenom undvika dess proteasomala nedbrytning, medan CK1δ-medierad fosforylering av Ci å andra sidan kan öka dess ubiquitination och dess partiella proteolys till den repressiva formen av Ci (CiR).
I Hpo-vägen kan CK1δ fosforylera ja-associerat protein (YAP), nedströms-co-aktivatorn av Hpo-responsiv gentranskription på Ser-381, vilket påverkar dess proteasomala nedbrytning. Dessutom verkar Hpo-signalvägen vara relaterad till båda, Wnt-signalering. och p53-reglering I närvaro av Wnt-ligand kan CKδ/ε fosforylera nyckeln Wnt-effektor Disheveled (Dvl) som hämmar β-catenin-destruktionskomplexet, vilket slutligen resulterar i en högre stabilitet av β-catenin. Här kan YAP/Tafazzin (TAZ) binda Dvl och minska dess CK1δ-medierade fosforylering. Dessutom kan β-catenin hållas kvar i cytoplasman efter bindning till YAP, vilket resulterar i lägre transkription av Wnt-responsiva gener.
Klinisk signifikans
Inom detta avsnitt kommer CK1δs funktion i förekomst, utveckling och utveckling av flera sjukdomar och störningar främst på cancer, neurologiska sjukdomar och metabola sjukdomar att diskuteras.
Carcinogenes
Avreglering av CK1δ bidrar till tumörbildning och tumörprogression genom avreglering av Wnt/β-catenin-, p53-, Hedgehog- och Hippo-relaterad signalering. CK1δ mRNA är överuttryckt i olika cancerenheter , bland dem cancer i urinblåsan, hjärncancer, bröstcancer, kolorektal cancer, njurcancer, lungadenokarcinom, melanom, äggstockscancer, pankreascancer, prostatacancer, hematopoetiska maligniteter och lymfoida neoplasmer. Även minskade CK1δ-mRNA-uttrycksnivåer har observerats i vissa cancerstudier, som urinblåscancer, lungskivepitelcancer, magcancer, njurcancer, matstrupscancer samt cancer i huvud och hals. Förutom dessa bromsade minskad CK1δ-aktivitet på grund av platsen N172D-mutation av CK1δ bröstkarcinomprogression och förlängde musöverlevnad i en transgen musmodell. De två CK1δ-mutationerna, R324H och T67S, identifierade i tarmslemhinnan respektive i en kolorektal tumör, uppvisar ökad cancerframkallande potential.
Neuropati och neurologiska sjukdomar
Onormalt uttryck av CK1δ i hjärnvävnad har hittats i många sjukdomar genom immunhistokemi och genuttrycksstudier, som Alzheimers sjukdom (AD), Downs syndrom (DS), progressiv supranukleär pares (PSP), parkinsonism demenskomplex av Guam (PDC), Picks sjukdom (PiD), pallido-ponto-nigral degeneration (PPND) och familjärt avancerad sömnfassyndrom (FASPS).
I typiska patologiska vävnader visar neuritiska plack (NP) eller granulovakuolära degenerationskroppar (GVB) av AD högt uttryck av CK1δ, medan uttrycket av CK1δ är lågt i neurofibrillära trassel (NFT). AD kännetecknande proteiner tau i NFTs eller GVBs och TAR DNA-bindande protein på 43 kDa (TDP-43) i GVBs samlokaliseras med CK1δ. In vitro fosforyleringsstudier visade att flera platser inom tau och TDP-43 fosforylerades av CK1δ. Minskning av platsspecifik fosforylering av TDP-43 genom hämning av CK1δ i båda, en neuronal cellmodell såväl som i en Drosophila-modell resulterade i förhindrande av neurotoxicitet och följaktligen till räddning av celler från celldöd. Baserat på dessa studier kan CK1δ erkännas som ett kännetecken såväl som ett potentiellt mål för AD-behandling och kan vara ytterligare användbar för diagnostiska och terapeutiska ändamål i framtiden. Dessutom spelar CK1δ en reglerande roll vid Parkinsons sjukdom (PD) genom att fosforylera α-synuklein. Familjärt avancerad sömnfassyndrom (FASPS) är en annan neurologisk sjukdom associerad med CK1δ-medierad fosforylering av däggdjursklockproteinet PER2. Efter platsspecifik fosforylering av CK1δ ökas stabiliteten för PER2 och halveringstiden för PER2 utökas. Dessutom kan PER2-stabilitet påverkas av CK1δ T344A-mutation och platsspecifik fosforylering av CK1δ vid Thr-347 av andra intracellulära kinaser.
CK1δ kan påverka metabol dysfunktion, särskilt i en fet situation, genom att förbättra glukostoleransen, minska glukoneogenesgenuttrycket och glukosutsöndringen eller öka basalt och insulinstimulerat glukosupptag. Vidare moduleras bildningen av den biologiskt aktiva formen med högre molekylvikt (HMW) av adiponektin, som är involverad i att reglera glukosnivåer och fettsyra som utsöndras från fettvävnad, av platsspecifik fosforylering av adiponektin av CK1δ.
Parasitiska CK1 kapar däggdjurs CK1-vägar
Allt fler bevis tyder på att CK1 kan associeras med infektionssjukdomar genom manipulering av värdcellens CK1-relaterade signalvägar av intracellulära parasiter , som exporterar deras CK1 till värdcellen. För Leishmania och Plasmodium bidrar utsöndrad CK1 till omprogrammering av respektive värdceller. Med värdfunktioner kan parasitära CK1:er ersätta däggdjurs-CK1:er och därigenom säkerställa liknande funktioner. Parasitiska CK1s visar en hög identitetsnivå gentemot mänsklig CK1δ TV1, vilket tyder på att denna mänskliga paralog kan vara det föredragna målet för parasitisk kapning. Proteinorganisationen för parasitiska CK1s är mycket lik den hos human CK1δ. Alla rester involverade i ATP-bindning, gatekeeper-resten, såväl som DFG-, KHD- och SIN-motiven är i allmänhet konserverade i parasitiska CK1-sekvenser. Detta fynd tyder på att de är avgörande för CK1-funktionen. Men funktionerna hos dessa kinaser i parasiterna och ännu viktigare deras funktioner i värdcellen är huvudsakligen okända och återstår att undersöka. CK1 från Plasmodium och Leishmania studeras mest:
- Den enda CK1 i Plasmodium , PfCK1 (PF3D7_1136500), uppvisar 69 % av identiteten med humant CK1 inom kinasdomänen och är avgörande för fullbordandet av den asexuella intraerytrocytiska cykeln. I likhet med andra CK1s har även PfCK1 flera bindningspartners och reglerar därmed potentiellt flera vägar, inklusive de som reglerar transkription, translation och proteinhandel. Slutligen verkar PfCK1 vara avgörande för parasitproliferation i erytrocyter.
- Från de sex CK1-paralogerna i Leishmania donovani är endast två paraloger, LdBPK_351020.1 och LdBPK_351030.1 (LmCK1.2), nära besläktade med mänsklig CK1. Den enda paralog som beskrivs ha en funktion i värdcellen. LdBPK_351030.1 är aktiv i både promastigoter och amastigoter. LmCK1.2 kan hämmas av den CK1-specifika inhibitorn D4476 och är viktig för intracellulär parasitöverlevnad. Hittills har endast ett fåtal substrat för LmCK1.2 identifierats och funktionerna av LmCK1.2 i parasiten är dåligt studerade. Även om LmCK1.2 är mycket identisk med humant CK1, har flera små molekyler identifierats för att specifikt rikta sig mot Leishmania CK1, vilket ger möjligheter till nya terapeutiska strategier.
Modulerande CK1δ-aktivitet
På grund av det faktum att CK1δ är involverad i reglering av olika cellulära processer görs det stora försök att påverka dess aktivitet. Eftersom förändringar av uttrycket och/eller aktiviteten såväl som förekomsten av mutationer inom den kodande sekvensen av CK1δ står för utvecklingen av olika sjukdomar, bland dem cancer och neurodegenerativa sjukdomar som AD, ALS, PD och sömnstörningar, har det mesta intresset först koncentrerade sig på utvecklingen av CK1δ-specifika småmolekylära hämmare (SMI). På grund av det faktum att CK1δ-mutanter isolerade från olika tumörenheter ofta uppvisar en högre onkogen potential än vildtyps-CK1δ finns det också stora ansträngningar för att generera SMIs som är mer selektivt hämmande CK1δ-mutanter än vildtyps-CK1δ. Dessa SMI skulle vara av stort kliniskt intresse eftersom de skulle öka det terapeutiska fönstret och minska terapeutiska biverkningar för behandling av proliferativa och neurodegenerativa sjukdomar. Men utvecklingen av CK1δ-specifika hämmare är mycket utmanande på grund av flera anledningar: (i) Hittills har de flesta av de utvecklade hämmarna klassificerats som ATP-kompetitiva hämmare som uppvisar off-target-effekter främst på grund av strukturella likheter mellan ATP-bindningsstället för CK1δ med de av andra kinaser och ATP-bindande proteiner, (ii) platsspecifik fosforylering av CK1δ, speciellt inom dess C-terminala regulatoriska domän, ökar ofta IC50-värdet för CK1δ-specifika inhibitorer, och (iii) på grund av deras hydrofoba karaktär är deras biotillgänglighet ofta väldigt låg. Under de senaste åren har flera SMIs med en mycket högre selektivitet mot CK1δ än för andra CK1- isoformer beskrivits som också är effektiva i djurmodeller. Behandling av råttor, möss, apor och zebrafiskar med PF-670462 (4-[3-cyklohexyl-5-(4-fluoro-fenyl)-3H-imidazol-4-yl]-pyrimidin-2-ylamin) resulterar i en fas förändring i dygnsrytm. Dessutom blockerar den amfetamininducerad rörelse hos råttor, förhindrar alkoholberövande effekt hos råtta och hämmar akut och kronisk bleomycin-inducerad lungfibros hos möss. PF-670462 stoppar också försämring orsakad av UVB-ögonbestrålning i en musmodell av ulcerös kolit, och minskar ackumuleringen av leukemiceller i det perifera blodet och mjälten i en musmodell för kronisk lymfatisk leukemi (KLL). PF-5006739 , 4-[4-(4-fluorfenyl)-1-(piperidin-4-yl)-1H-imidazol-5-yl]pyrimidin-2-aminderivat har visats försvaga det opioidläkemedelssökande beteendet hos gnagare. Dessutom leder det till en fasfördröjning av dygnsrytmen i natt- och dygnsdjurmodeller. N-bensotiazolyl-2-fenylacetamidderivat utvecklade av Salado och medarbetare visar skyddande effekter på in vivo hTDP-43 neurotoxicitet i Drosophila .
Intressant nog visar hämmare av Wnt-produktion (IWP), kända för att hämma O-acyltransferas porcupine (Porcn) och vara antagonister av Wnt-vägen, strukturella likheter med bensimidazolbaserade CK1-hämmare, bland dem Bischof-5 och är därför mycket potenta i specifikt hämmar CK15. Ytterligare utveckling av IWP-derivat resulterade i förbättrade IWP-baserade ATP-kompetitiva hämmare av CK1δ. Sammanfattningsvis kan man dra slutsatsen att de cellulära effekterna som medieras av IWP inte bara beror på hämningen av Porcn, utan också på hämning av CK1δ-beroende signalvägar. Dessa data visar tydligt en hög potential av CK1δ-specifika hämmare för personliga terapikoncept för behandling av olika tumörenheter (t.ex. bröstcancer, kolorektal cancer och glioblastom), leukemi, neurodegenerativa sjukdomar som AD, PD och AL, och sömnstörningar. Dessutom verkar CK1δ-specifika hämmare uppvisa hög relevans för prognostiska tillämpningar. I detta sammanhang kunde det visas att [ 11C ]-märkta mycket potenta difluoro-dioxolo-bensoimidazol-bensamider kan användas som PET-radiospårare och för avbildning av AD.
Eftersom hämmare av små molekyler ofta har olika nackdelar, inklusive låg biotillgänglighet, effekter utanför målet samt allvarliga biverkningar, är intresset för utveckling och validering av nya biologiska verktyg som identifiering av biologiskt aktiva peptider som antingen kan hämma CK1δ-aktivitet eller interaktionen. av CK1δ med cellulära proteiner växer mer och mer. Användningen av peptidbibliotek resulterade i identifieringen av peptider som specifikt kan blockera interaktionen av CK1δ med tubulin, RNA-helikaset DDX3X och Axin. Bindning av peptid δ-361 till α-tubulin ledde inte bara till blockering av interaktionen av CK1δ med α-tubulin, den inhiberade också selektivt fosforylering av GST-α-tubulin av CK1δ. Behandling av cancerceller med peptid δ-361 resulterade slutligen i mikrotubuli destabilisering och celldöd. Finkartläggning av DDX3X-interaktionsdomänerna på CK1δ, CK1δ-peptiderna δ-1 och δ-41 identifierades för att kunna blockera interaktionerna av CK1δ med det X-länkade DEAD box-RNA-helikaset DDX3X såväl som kinasaktiviteten av CK15. Dessutom kunde dessa två identifierade peptider hämma stimuleringen av CK1- kinasaktivitet i etablerade cellinjer. Eftersom DDX3X-mutationer är närvarande hos patienter med medulloblastom ökar aktiviteten av CK1 i levande celler och därefter aktiverar CK1-reglerade vägar som Wnt/β-catenin och hedgehog-signalering, kan de identifierade interaktionsblockerande peptiderna vara användbara i personliga terapikoncept för behandlingen av Wnt/β-catenin- eller Hedgehog-driven cancer. Under 2018 finkarterades interaktionen mellan Axin1, ett ställningsprotein som uppvisar viktiga roller i Wnt-signalering, och CK1δ/ε med hjälp av ett peptidbibliotek. De identifierade Axin1-härledda peptiderna kunde blockera interaktionen med CK1δ/ε. Eftersom Axin1 och Dvl också konkurrerar om CK1δ/ε-medierad platsspecifik fosforylering kan det konstateras att Axin 1 spelar en viktig roll för att balansera CK1δ/ε-medierad fosforylering av Dvl såväl som för aktiveringen av kanonisk Wnt-signalering.
Se även
Anteckningar
externa länkar
- Mänskligt CSNK1D- genomplacering och CSNK1D- geninformationssida i UCSC Genome Browser .
- Översikt över all strukturell information tillgänglig i PDB för UniProt : P48730 (Human Casein kinas I isoform delta) på PDBe-KB .
- Översikt över all strukturell information tillgänglig i PDB för UniProt : Q9DC28 (Mouse Casein kinas I isoform delta) på PDBe-KB .







