Blå flaska experiment
Experimentet med blå flaska är en kemisk redoxreaktion som ändrar färg . En vattenlösning innehållande glukos , natriumhydroxid , metylenblått bereds i en sluten flaska som innehåller lite luft. När den står övergår den spontant från blått till färglöst på grund av reduktion av metylenblått av den alkaliska glukoslösningen. Skakning av flaskan oxiderar dock metylenblått tillbaka till sin blå form. Med ytterligare skakning kan denna färgbytescykel upprepas många gånger. Detta experiment är en klassisk kemidemonstration som kan användas i laboratoriekurser som ett allmänt kemiexperiment för att studera kemisk kinetik och reaktionsmekanism . Reaktionen fungerar också med andra reduktionsmedel förutom glukos och andra redoxindikatorfärgämnen förutom metylenblått.
Reaktioner
Historia och allmänt begrepp
Mekanismen för experimentet med blå flaska kräver förståelse för hastigheter och mekanismer för komplexa interagerande kemiska reaktioner. I komplexa kemiska reaktioner kan individuella delreaktioner inträffa samtidigt men med avsevärt olika hastigheter. Dessa kan i sin tur påverkas av reagenskoncentration och temperatur . I de flesta fall bestäms den totala reaktionshastigheten av den snabbaste enkomponentreaktionen. Men när vissa processer bildar mellanliggande molekyler som sedan reagerar i andra processer för att bilda slutprodukten, bestäms hastigheten för den totala reaktionen av hastigheten för den långsammaste reaktionen. Under sådana omständigheter är mellanprodukterna vanligtvis i ett stabilt tillstånd vid låga koncentrationer eftersom de är mycket reaktiva. Jämviktstillstånd kräver att all reaktion framåt och bakåt sker i samma takt. Således bestäms den totala nettoreaktionen av summan av alla mekanismsteg där hastigheten beror på koncentrationen och temperaturen. Experimentet med blå flaska illustrerar denna princip för att interagera reaktioner med olika hastigheter.
Experimentet med blå flaska kräver endast tre reagens: kaliumhydroxidlösning , dextroslösning och utspädd metylenblåttlösning . Dessa reagens tillsätts till en kolv, blandas och kolven tillsluts. Lösningens initiala färg är blå, men när den får stå under ett kort intervall bleknar den spontant till färglös, eftersom den alkaliska dextroslösningen reducerar metylenblått till färglöst leuko-metylenblått. Skakning av kolven gör att syre som finns i huvudutrymmets luft löses i lösningen och oxiderar leuko-metylenblått tillbaka till sin färgade form igen. En annan variant använder metylenblått i vatten, glukos och kaustiksoda ( NaOH ). Det finns många versioner av experimentet, men till skillnad från den klassiska versionen där färg är nödvändigt att använda som en katalysator för reaktionen, genomgår de gröna och snabba versionerna autooxidation även i frånvaro av färgämnet.
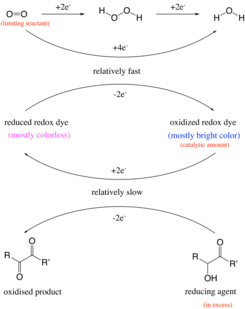
Tidigare trodde man att reaktionen skedde genom oxidation av en aldehydgrupp till en karboxylsyra under alkaliska förhållanden. Till exempel skulle glukos oxideras till glukonat av syre . Experimentet fungerar dock även med föreningar som C-vitamin och bensoin , som inte innehåller en aldehydgrupp. Således är reaktionen faktiskt oxidation av en acyloin eller besläktad α - hydroxikarbonylgrupp , som är en strukturell egenskap hos glukos, till en 1,2-diketon . Det reducerade redoxfärgämnet (färglöst tillstånd) bildas av oxiderat redoxfärgämne (blått). Färgförändringen som inträffar i experimentet med blå flaska har drag av en klockreaktion , där en synlig förändring i koncentrationen av ett eller flera reagens plötsligt inträffar när ett begränsande reagens är uttömt. Till exempel förbrukas den begränsande reaktanten, syre, av en annan reaktant, bensoin, med hjälp av safranin som katalysator. När den begränsade mängden syre har förbrukats kan katalysatorn inte ändra form, och som ett resultat ändrar lösningen färg.
Klassisk version
Vattenlösningen i den klassiska reaktionen innehåller glukos , natriumhydroxid och metylenblått . I det första steget bildas en acyloin av glukos. Nästa steg är en redoxreaktion av acyloinet med metylenblått där glukosen oxideras till diketon i alkalisk lösning och metylenblått reduceras till färglöst leukoetylenblått. Om det finns tillräckligt med syre tillgängligt (dvs. efter att ha skakat flaskan), oxideras leukometylenblått omedelbart till metylenblått och den blå färgen på lösningen består. Men när lösningen lämnas att vila förbrukas det lösta syret gradvis irreversibelt, och vid den punkt där det har blivit helt uttömt, fortgår glukosreduktionen av metylenblått oavbrutet och färgen på lösningen försvinner snabbt. Reaktionen är första ordningens i glukos, metylenblått och hydroxidjon och nollordningen i syre. Processen kan beskrivas som en pseudo första ordningens reaktion och kan användas för att illustrera de ändrade koncentrationerna av reagenserna under reaktionens gång när lösningen ändras från blå tillbaka till färglös.
De slutliga glukosoxidationsprodukterna förutom natriumglukonat har identifierats som D -arabino-hexos-2-ulos ( glukoson ), anjonen av D -arabinonat efter avspaltning av en formiatanjon och arabinonsyra.
Grön version
Wellman och Noble föreslog en ny formulering för Blue Bottle-experimentet där C-vitamin fungerar som ett reduktionsmedel istället för glukos; metylenblått och syre används fortfarande. Koppar tillsätts som en katalysator för återoxidation av leukometylenblått till metylenblått . Dessa modifieringar ger ett experiment som genererar en mindre mängd avfall som är mindre frätande och lättare att neutralisera, och därför är ett exempel på grön kemimodifiering .
Snabb version
Chen-autooxidationen av bensoin hade utfört ett liknande experiment med avseende på de klassiska och gröna versionerna. Det visade sig att trafikljus- och försvinnande valentin- experimenten kan bli framgångsrika oavsett om ett socker tillsätts. En variation är snabbare, med antalet färgbytescykler som inte varar lika länge som de klassiska och gröna versionerna eftersom reaktanterna är närvarande i mindre mängder; även reduktionsmedlet för detta experiment är bensoin, som tillsätts för att öka antalet cykler i lösningen. Dessutom är den användbara perioden i detta experiment ganska kort. Även om experimentet förbereds över natten, kan reduktionsmedlet tillsättas när som helst för att kunna observera lösningen mer.
Enzymatisk version
Zhang, Tsitkov och Hess från Columbia University föreslog en enzymatisk version av "blå flaska experimentet". De kallade det "gröna flaska experimentet", eftersom systemet är färgat grönt och reagenserna är säkrare än klassiska metoder. Experimentet utförs i en genomskinlig glasflaska som innehåller två vanliga enzymer ( glukosoxidas och pepparrotsperoxidas ), glukos och 2,2'-azino-bis(3-etylbensotiazolin-6-sulfonsyra) (förkortat ABTS) i PBS-buffert . Ett tunt lager olja används för att blockera lösningen från luften. Lösningen blir först grön och blir sedan färglös med utarmning av löst syre. Skakning av lösningen introducerar färskt syre och färgar lösningen grön igen tills syret är förbrukat.
Denna version förlitar sig på tre enzymatiska reaktioner. För det första katalyserar glukosoxidasen oxidationen av glukos i närvaro av syre och producerar väteperoxid. För det andra använder pepparrotsperoxidaset väteperoxiden för att oxidera ABTS till dess radikalkatjoniska form, ABTS +• . När det lösta syret förbrukas i lösningen sker den tredje reaktionen: glukosoxidas katalyserar reduktionen av ABTS +• tillbaka till ABTS i närvaro av glukos. Detta system kan också bilda vackra mönster som härrör från reaktionsdriven Rayleigh–Bénard-konvektion.
Variation av färgämnen
De kemiska reaktionerna och mekanismerna i experimentet med blå flaska är beroende av oxidation av ett socker med hjälp av luft och ett redoxfärgämne i en basisk lösning. Andra varianter av denna reaktion har rapporterats som använder fyra familjer av redoxfärgämnen : tiaziner , oxaziner , aziner och indigokarmin har alla rapporterats fungera med glukos och kaustiksoda .
Kemiskt trafikljusexperiment
Det kemiska trafikljuset är en färgskiftande redoxreaktion som är relaterad till experimentet med blå flaska . En av de tidiga formlerna består av glukos , natriumhydroxid , indigokarmin (färgämne) och vatten . En annan formel består av indigokarmin , askorbinsyra ( vitamin C ), natriumbikarbonat , natriumklorid , koppar(II)sulfat , natriumhydroxid och vatten . Genom att göra det minskar kemiskt avfall och halten av frätande kemikalier. Mängden fasta kemikalier som löstes upp i experimentet kunde minskas från 60 gram till 6 gram. Och pH-värdet kan sänkas från 13 till 3, vilket är lättare att neutralisera pH-värdet till 7 genom att tillsätta bakpulver före kassering. Dessutom är det säkrare och reaktionerna sker också snabbare och är lättare att utföra.
Till en början läggs alla kemikalier ihop och färgen ser gul ut. Efter skakning blir färgen grön och ändras sedan till röd efter att den lämnats orörd. Vid ytterligare observation blir färgen tillbaka till gul, varför lösningen kallas det kemiska trafikljuset. Denna reaktion kan upprepas många gånger, men den behöver ytterligare syre eller indigokarmin .
Denna reaktion sker genom oxidation och reduktion av lösningen där alkalisk glukoslösning fungerar som ett reduktionsmedel . Glukoslösningen tillsätts till lösningen som innehåller indikator (färgämne indigokarmin) färgförändringarna sker. Denna reaktion är också känd som kemiskt klockexperiment eftersom koncentrationerna av produkterna och reaktanterna ändrades under den specifika perioden. När lösningen skakas löses syre i lösningen och oxiderar indigokarmin. Lösningen blir röd om en liten mängd syre löses upp och grön om all indigokarmin oxideras. Lösningen kommer att återgå till den ursprungliga gula färgen när syrekoncentrationen sjunker.
Kemisk trafikljusreaktion time-lapse
Försvinnande alla hjärtans experiment
Försvinnande valentin-experimentet är en annan kemisk reaktion relaterad till experimentet med blå flaska . Denna reaktion inträffar när vatten, glukos , natriumhydroxid och resazurin blandas i en kolv. När lösningen skakas övergår den från ljusblå till rödaktig färg. Lösningen blir tillbaka till en ljusblå färg efter att ha fått stå en stund. Denna reaktion kan upprepas flera gånger.
Efter att ha blandat alla komponenter, skaka flaskan och färgen blir röd eller rosa beroende på mängden resazurin i lösningen. Mer resazurin kommer att resultera i mer tid som behövs för lösningen att vända tillbaka färgen och intensiteten i den röda färgen.
Den kemiska reaktionen stimulerar glukos att reducera resazurin till resorufin. Det skulle sedan reduceras igen till en färglös förening som kallas dihydroresorufin. När dihydroresorufin skakas oxideras den tillbaka till resorufin. Detta beror på det faktum att skakning resulterar i syre i flaskan till oxiderad dihydroresorufin tillbaka till resorufin.
lösningen förvandlas från färglös till röd
Andra
- Gatorade
Erioglaucin , ett livsmedelsfärgämne och ett redoxfärgämne, visade sig vara ett effektivt substitut för metylenblått i experimentet med blå flaska. Eftersom vissa godisar och drycker som Gatorade innehåller färgämnet och ett reducerande socker, behöver bara natriumhydroxid tillsättas för att förvandla dessa livsmedel till en blå flaskalösning.
- Lila kolv
Tionin kan användas i den gröna versionen av experimentet i kombination med koppar/järnkatalysator för att skapa den lila kolven.
Mönsterbildning
Mönsterbildning är när en lösning som innehåller NaOH, glukos och färgämne hälls i en petriskål som är öppen mot atmosfären. Detta kommer att resultera i att lösningen ändrar sin struktur över en tidsperiod. Strukturer uppstår från molekylär transport genom diffusion och kemisk kinetik . Mönster som bildas i petriskålen kan beskrivas som ett mosaikmönster; webbliknande, dynamisk spiral, förgrening och linjer som ansluter till varandra.
Förändringar i mönsterbildningen är inte homogena och kan påverkas av flera faktorer. Olika typer av färgämne i lösning kommer att ge samma mönster på grund av bindningens bildning och dynamiken förblir densamma, detta beror på att lösningen har samma färg som färgen. Olika mängder färgämne kan resultera i densitetsförändringar i lösningen och detta resulterar i en förändring av konvektiv rörelse. Olika mängder färgämne kan ta in olika mängder konventionella celler som också bildas av olika mängder glukos och oxiderad produkt. Detta kan resultera i intressanta rumsliga fenomen. Tid kan också påverka mönsterbildningen. Allt eftersom tiden gick försvann ett mönster gradvis. Spiraler och grenar började försvinna och försvann så småningom helt. Dessa fakta indikerar att syre påverkar den kemiska reaktionen och detta spelar en grundläggande roll i mönsterbildningen. Mönsterbildning kan också bildas från en kemiskt driven konvektiv instabilitet. Detta innebär att materia utbyts över luft-reaktionsblandningens gränssnitt, på grund av fluktuationerna i den molekylära naturen hos kemiska system. Temperaturen kan påverka mönsterbildningen. Kallare temperatur bildade ett tydligare mönster än varm temperatur. Formen på petriskålen bidrog också till mönsterbildningen.
Mönsterbildning från Blue Bottle-experiment i isvattenbad Time-lapse
Mönsterbildning från Blue Bottle-experiment i kallvattenbad Time-lapse
Mönsterbildning från Blue Bottle-experiment i rumstemperatur Time-lapse
Mönsterbildning från Blue Bottle Experiment i Varmvattenbad Time-lapse
Kemiskt trafikljusexperiment mönsterbildning i behållare med olika former Time-lapse
En grupp forskare vid University of Glasgow vid namn Pons, Batiste och Bees kom med en liten slutsats om mönsterbildning i metylenblått-glukossystemet. De kom med ett avgörande uttalande att ett liknande mönster kan bildas i en behållare med tillgängligt syre. Denna resulterande ytspänningseffekt krävs inte för att producera instabiliteten. Små hål hittades också i locket på behållaren som syre inte kan komma åt vilket resulterade i en tunn, blå och lägre mängd syre. Mönsterlängd och tidsskala hade undersökts i ett av deras experiment på grund av variationen i viskositet och vätskedjup. Experimentet avslöjar att våglängden bildas när ett mönster snabbt börjar bildas. Då kan våglängden eller mönstret bibehållas eller svänga ett tag.
- ^ a b Baker, Colin (1 november 2006). "Den 'blå flaskan' reaktionen" . Utbildning i kemi . Vol. 43, nr. 6. Royal Society of Chemistry . sid. 155.
- ^ Engerer, Steven C.; Cook, A. Gilbert (1999). "The Blue Bottle Reaction as a General Chemistry Experiment on Reaction Mechanisms". Journal of Chemical Education . 76 (11): 1519–1520. doi : 10.1021/ed076p1519 .
- ^ Kock A. Gilbert; Tolliver, Randi M.; Williams, Janelle E. (1994). "The Blue Bottle Experiment Revisited: How Blue? How Sweet?". Journal of Chemical Education . 71 (2): 160. Bibcode : 1994JChEd..71..160C . doi : 10.1021/ed071p160 .
- ^ a b c Limpanuparb, Taweetham; Areekul, Cherprang; Montriwat, Punchalee; Rajchakit, Urawadee (2017). "Blue Bottle Experiment: Lär dig kemi utan att känna till kemikalierna". Journal of Chemical Education . 94 (6): 730. Bibcode : 2017JChEd..94..730L . doi : 10.1021/acs.jchemed.6b00844 .
- ^ Limpanuparb, Taweetham; Roongruangsree, Pakpong; Areekul, Cherprang (2017). "En DFT-undersökning av experimentet med blå flaska: E∘ halvcellsanalys av autooxidation katalyserad av redoxindikatorer" . Royal Society Open Science . 4 (11): 170708. doi : 10.1098/rsos.170708 . PMC 5717635 . PMID 29291061 .
- ^ a b c d Limpanuparb, Taweetham; Ruchawapol, Chattarin; Pakwilaikiat, Puh; Kaewpichit, Chatchapong (2019). "Kemiska mönster i autooxidationer katalyserade av redoxfärgämnen" ( PDF) . ACS Omega . 4 (4): 7891–7894. doi : 10.1021/acsomega.9b00802 . PMC 6648442 . PMID 31459876 .
- ^ Campbell, JA (1963). "Kinetik tidigt och ofta". Journal of Chemical Education . 40 (11): 578–583. doi : 10.1021/ed040p578 .
- ^ Musse, Charles D. (1980). "Kemisk kinetik: Reaktionshastigheter". Journal of Chemical Education . 57 (9): 659. doi : 10.1021/ed057p659 .
- ^ Dutton, FB (1960). "Methylene Blue - Reduction and Oxidation". Journal of Chemical Education . 37 (12): A799. doi : 10.1021/ed037pA799.1 .
- ^ Limpanuparb, Taweetham; Ruchawapol, Chattarin; Sathainthammanee, Dulyarat (2019). "Clock Reaction Revisited: Catalyzed Redox Substrate-Depletive Reactions". Journal of Chemistry Education . 96 (4): 812−818. doi : 10.1021/acs.jchemed.8b00547 . S2CID 104370691 .
-
^ a b
Kerdkaew, Thitipong; Limpanuparb, Taweetham (2020). "The Blue Bottle Experiment Revisited: How Much Oxygen?" . Journal of Chemical Education . 97 (4): 1198–1202. doi : 10.1021/acs.jchemed.9b01103 . S2CID 216217791 .
{{ citera tidskrift }}: CS1 underhåll: flera namn: lista över författare ( länk ) - ^ Olah, Herbert W. Roesky (2007). Spektakulära kemiska experiment (1:a Aufl. utg.). Weinheim: Wiley-VCH. ISBN 978-3-527-31865-0 .
- ^ a b Anderson, Laurens ; Wittkopp, Stacy M.; Målare, Christopher J.; Liegel, Jessica J.; Schreiner, Rodney; Bell, Jerry A.; Shakhashiri, Bassam Z. (2012). "Vad händer när den blå flaskan bleker: en undersökning av den metylenblåkatalyserade luftoxidationen av glukos". Journal of Chemical Education . 89 (11): 1425–1431. doi : 10.1021/ed200511d .
- ^ Shakhashiri, Bassam Z. (1985). Kemiska demonstrationer ([Nachdr.] red.). Madison, Wis.: Univ. från Wisconsin Press. s. 142–143. ISBN 978-0-299-10130-5 .
- ^ Summerlin, Lee R. (1988). Kemiska demonstrationer (2:a upplagan). Washington, DC: American Chem. Samhälle. sid. 127. ISBN 9780841214811 .
- ^ a b Wellman, Whitney E.; Noble, Mark E.; Healy, Tom (2003). "Gröna den blå flaskan". Journal of Chemical Education . 80 (5): 537. Bibcode : 2003JChEd..80..537W . doi : 10.1021/ed080p537 .
- ^ a b Rajchakit, Urawadee; Limpanuparb, Taweetham (2016). "Greening the Traffic Light: Air Oxidation of Vitamin C Catalyzed by Indicators". Journal of Chemical Education . 93 (8): 1486–1489. Bibcode : 2016JChEd..93.1486R . doi : 10.1021/acs.jchemed.5b00630 .
- ^ Chen, Philip S. (1970). "Autoxidation av bensoin". Journal of Chemical Education . 47 (1): A67. Bibcode : 1970JChEd..47...67C . doi : 10.1021/ed047pA67.1 .
- ^ a b Rajchakit, Urawadee; Limpanuparb, Taweetham (2016). "Rapid Blue Bottle Experiment: Autoxidation of Benzoin Catalyzed by Redox Indicators". Journal of Chemical Education . 93 (8): 1490–1494. Bibcode : 2016JChEd..93.1490R . doi : 10.1021/acs.jchemed.6b00018 .
- ^ Zhang, Yifei; Tsitkov, Stanislav; Hess, Henry (2018). "Komplex dynamik i ett tvåenzymreaktionsnätverk med substratkonkurrens". Naturkatalys . 1 (4): 276–281. doi : 10.1038/s41929-018-0053-1 . S2CID 104228290 .
- ^ En film finns här: Green bottle experiment
- ^ Mann, Georgia. "Kemiveckan: Kemiskt trafikljus" . Hämtad 17 juli 2019 .
- ^ "Kemiskt trafikljus" . MEL Vetenskap . Hämtad 17 juli 2019 .
- ^ Altott, april. "Trafikljus" . Hämtad 17 juli 2019 .
- ^ "Vanishing Valentine Chemistry Demonstration" . Hämtad 13 november 2015 . [ permanent död länk ]
- ^ "The Vanishing Valentine" (PDF) . Arkiverad från originalet (PDF) den 16 februari 2016 . Hämtad 13 november 2015 .
- ^ Campbell, Dean J.; Staiger, Felicia A.; Peterson, Joshua P. (2015). "Variationer på demonstrationen av "Blue-Bottle" med matvaror som innehåller FD&C Blue #1". Journal of Chemical Education . 92 (10): 1684–1686. doi : 10.1021/acs.jchemed.5b00190 .
- ^ Weinberg, Richard B. (2019). "The Purple Flask: A Novel Reformulering of the Blue Bottle Reaction". Journal of Chemical Education . 97 : 159-161. doi : 10.1021/acs.jchemed.9b00627 . S2CID 209704047 .
- ^ Adamcíková, L'ubica; Sevcík, Peter (1998-12-01). "The Blue Bottle Experiment - Enkel demonstration av självorganisering". Journal of Chemical Education . 75 (12): 1580. doi : 10.1021/ed075p1580 . ISSN 0021-9584 .
- ^ Pons, AJ; Sague's, F.; Bees, MA; Sørensen, P. Graae (2000). "Mönsterbildning i metylen-blått-glukossystemet". Journal of Physical Chemistry B . 104 (10): 2251–2259. doi : 10.1021/jp9935788 .
- ^ Adamčíková, L`; Ševčík, P. (1997). "Experimentet med blå flaska och mönsterbildningen i detta system" . Z. Naturforsch . 52 (8–9): 650–654. doi : 10.1515/zna-1997-8-918 .
- ^ Pons, AJ; Batiste, O.; Bees, MA (2008). "Icke-linjär kemokonvektion i metylen-blått-glukossystemet: Tvådimensionella grunda lager". Fysisk granskning E . 78 (1): 016316. doi : 10.1103/PhysRevE.78.016316 . hdl : 2445/18933 . PMID 18764059 .