Aktinsammansättningsinducerande protein
| Aktinsammansättningsinducerande protein | |||||||
|---|---|---|---|---|---|---|---|
 EVH1-domän-ActA-
| |||||||
| peptidkomplexidentifierare | |||||||
| Symbol | ActA | ||||||
| NCBI-genen | 2798121 | ||||||
| UniProt | P33379 | ||||||
| |||||||
Actin assembly-inducing protein ( ActA ) är ett protein som kodas för och används av Listeria monocytogenes för att driva sig själv genom en däggdjursvärdcell. ActA är ett bakteriellt ytprotein som omfattar en membranomspännande region. I en däggdjurscell interagerar bakteriell ActA med Arp2/3-komplexet och aktinmonomerer för att inducera aktinpolymerisation på bakterieytan och genererar en aktinkometsvans. Genen som kodar för ActA benämns actA eller prtB.
Introduktion
Så fort L. monocytogenes -bakterier intas av människor, internaliseras de i tarmepitelceller och försöker snabbt undkomma sin internaliseringsvakuol. I cytosolen börjar de polymerisera aktin på sin yta med hjälp av ActA-proteinet. Det har visat sig att ActA inte bara är nödvändigt utan också tillräckligt för att inducera motilitet hos bakterier i frånvaro av andra bakteriella faktorer.
Upptäckt
ActA upptäcktes genom att analysera lecitinasnegativa Tn 917-lac Listeria-mutanter på grund av fenotypen att de inte kunde spridas från cell till cell. Dessa muterade bakterier flydde fortfarande från fagosomer lika effektivt som vildtypsbakterier och förökade sig i de infekterade cellerna, men de var inte omgivna av aktinliknande vildtypsbakterier. Ytterligare analys visade att Tn 917-lac hade infogats i actA , den andra genen av ett operon. Den tredje genen av detta operon, plcB , kodar för L. monocytogenes lecitinaset. För att bestämma om själva actA , plcB eller andra samtranskriberade nedströmsregioner är involverade i aktinsammansättningen, genererades mutationer i de lämpliga generna. Alla mutanter utom actA- mutanterna liknade vildtyp vad gäller association med F-aktin och cellcellspridning. Komplementering med actA återställde vildtypsfenotyp i actA- mutanterna.
Fungera
ActA är ett protein som fungerar som en efterlikning av Wiskott-Aldrichs syndromprotein (WASP), en kärnbildningsfrämjande faktor (NPF) som finns i värdceller. NPFs i däggdjurscellen rekryterar och binder till det redan existerande aktinrelaterade protein 2- och 3-komplexet (Arp2/3-komplex) och inducerar en aktiverande konformationsförändring av Arp2/3-komplexet. På grund av denna konformationsförändring initierar NPF polymerisation av ett nytt aktinfilament i en 70° vinkel, vilket leder till de karakteristiska Y-förgrenade aktinstrukturerna i framkanten av rörliga celler. ActA lokaliseras till bakteriens gamla pol och sträcker sig över både bakteriecellsmembranet och cellväggen, lateral diffusion hämmas; sålunda lokaliseras ActA på ett polariserat och förankrat sätt på bakterieytan. Följaktligen startar aktinpolymerisation endast i denna region på ytan av bakterien. Expression av ActA induceras endast efter att ha kommit in i en däggdjursvärdcell.
Aktinfilamentaggregatet genererar kraften som driver bakterien i däggdjursvärdcytoplasman framåt. Kontinuerlig aktinpolymerisation är tillräcklig för motilitet i cytoplasman och även för infektion av intilliggande celler.
Forskning
Nya data indikerar att ActA spelar en roll även vid vakuolär störning. En deletionsmutant av ActA var defekt i att permeabilisera vakuolen. En sträcka på 11 aminosyror av N-terminalen av den sura regionen (32-42) visade sig vara viktig för störning av fagosomen .
Strukturera
Den primära proteinhaltiga produkten av actA -genen består av 639 aminosyror och inkluderar signalpeptiden (första N-terminala 29 aminosyror) och ActA-kedjan (C-terminala 610 aminosyror). Därför består sekvensen av det mogna ActA-proteinet av 610 aminosyror. ActA har en molekylvikt på 70 349 Da och är ett ytprotein.
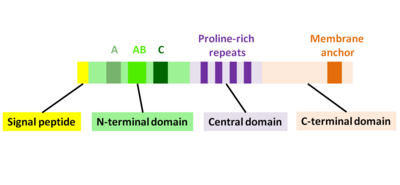
ActA är ett naturligt oveckat protein som kan delas in i tre funktionella domäner (Fig. 2):
- N-terminal domän som är högt laddad: aminosyrarester 1-234
- central domän med prolinrika upprepningar: aminosyrarester 235-394
- C-terminal domän med en transmembrandomän: aminosyrarester 395-610
N-terminal domän
De första 156 aminosyrorna i den N-terminala domänen består av tre regioner (Fig. 2):
- A-region med en sträcka av sura rester: 32-45
- AB-region, en aktinmonomerbindande region: 59-102
- C-region, en kofilinhomologisekvens: 145-156
Den N-terminala delen av ActA spelar en viktig roll vid aktinpolymerisation. Domänen uppvisar konsensuselement som finns i eukaryota WASP-familjen NPF som inkluderar en aktinmonomerbindande region såväl som en Arp2/3-bindande C (central eller cofilin homologi) och A (sur) region. Den aktinmonomerbindande regionen i ActA har funktionella egenskaper som WASP-Homology-2 (WH2) eller V-domänen, men skiljer sig i sekvensen. I WASP-familjens NPF är ordningen för domänerna WH2 följt av C och sedan av A, vilket inte är fallet i ActA.
Central domän
Den centrala prolinrika regionen i ActA är avgörande för att säkerställa effektiv bakteriell motilitet. Det finns fyra prolinrika upprepningar som innehåller antingen FPPPP- eller FPPIP-motiv. Dessa regioner efterliknar de hos värdcellens cytoskelettprotein zyxin , vinkulin och palladin , kända för att associera med fokala vidhäftningar eller stressfibrer. Det vasodilatorstimulerade fosfoproteinet ( VASP ) kan binda genom sin Ena/VASP-homologi 1-domän ( EVH1-domän ) till den centrala prolinrika regionen och rekryterar profilin , ett aktinmonomerbindande protein, som i sig främjar polymerisation vid hullingförsedda ändar av aktinfilament. Dessutom verkar VASP interagera med F-aktin genom dess karboxiterminala EVH2-domän, vilket ger en koppling av bakterien till svansen. Detta påstående stöds av det faktum att ActA kan binda flera Ena/VASP-proteiner samtidigt och har en hög affinitet mellan ActA och Ena/VASP. VASP har visat sig minska frekvensen av aktin-Y-grenar in vitro och ökar därmed andelen filament som är organiserade i en parallell inriktning i kometsvansar.
C-terminal domän
Den C-terminala domänen av ActA har en hydrofob region som förankrar proteinet i bakteriemembranet.
Sammanfattningsvis dessutom
- frånvaron av sekvenshomologi i den aktinbindande regionen och
- en förändring i sekvensen av ARP2/3-aktiverande domäner som är typiska för WASP-familjens NPF (V(WH2)-CA),
- en stor skillnad mellan ActA och värd-NPF är att ActA inte har element som binder till regulatoriska proteiner som Rho-familjen GTPaser. Denna strukturella skillnad mellan ActA och värd-NPF kan vara fördelaktig för L. monocytogenes och dess patogenes eftersom aktinkärnbildningsaktiviteten hos L. monocytogenes är oberoende av värdreglering.
Analoger
WASP/N-WASP, som funktionellt efterliknas av ActA, är mycket konserverad i eukaryoter. Det är en viktig aktin-cytoskelettorganisator och är avgörande för processer som endocytos och cellmotilitet. Aktiverad av Cdc42 , en Rho-familj liten GTPase, aktiverar WASP/N-WASP Arp2/3-komplexet, vilket leder till snabb aktinpolymerisation.
Aktinbaserad motilitet hos andra patogener
I Shigella aktiverar proteinet IcsA N-WASP , som i icke-infekterade däggdjursceller aktiveras av GTPase Cdc42. Aktiv N-WASP/WASP leder till aktinpolymerisation genom att aktivera Arp2/3-komplexet. Däremot Listeria ActA-proteinet med och aktiverar Arp2/3-komplexet direkt.
Rickettsia RickA-proteinet kan också aktivera Arp2/3-komplexet på ett WASP-liknande sätt . I motsats till Listeria är aktinfilamenten organiserade i långa, ogrenade parallella buntar. Arp2/3-komplexet är endast lokaliserat nära bakterieytan och därför antas det att en mer frekvent Arp2/3-komplexoberoende förlängning inträffar.
I Burkholderia initierar pseudomallei BimA aktinpolymerisation in vitro. Det antas att intracellulär migration av denna bakterie fungerar oberoende av Arp2/3-komplexet.
Se även
externa länkar
- YouTube-video från Nature , Listeria monocytogenes [2:00–4:12]