Sonodynamisk terapi
Sonodynamisk terapi (SDT) är en icke-invasiv behandling, som ofta används för tumörbestrålning, som använder en sonosensibilisator och djup penetration av ultraljud för att behandla lesioner av olika djup genom att minska antalet målceller och förhindra framtida tumörtillväxt. Många befintliga cancerbehandlingsstrategier orsakar systemisk toxicitet eller kan inte penetrera vävnad tillräckligt djupt för att nå hela tumören; Emellertid skulle nya ultraljudsstimulerade terapier kunna erbjuda ett alternativ till dessa behandlingar med ökad effektivitet, större penetrationsdjup och minskade biverkningar. Sonodynamisk terapi kan användas för att behandla cancer och andra sjukdomar, såsom åderförkalkning, och minska risken förknippad med andra behandlingsstrategier eftersom den endast inducerar cytotoxiska effekter när den stimuleras externt av ultraljud och endast i cancerområdet, i motsats till systemisk administrering av kemoterapiläkemedel.
Reactive oxygen species (ROS) är en väsentlig komponent i SDT eftersom de tillhandahåller cytotoxiciteten för sonodynamisk terapi; de produceras när ultraljud kopplas till ett sensibiliserande läkemedel och molekylärt syre. Utan ultraljud är läkemedlet inte giftigt. Men när läkemedlet väl utsätts för ultraljud och molekylärt syre blir det giftigt. Fotodynamisk terapi , från vilken sonodynamisk terapi härrörde, använder en liknande mekanism. Istället för ultraljud används ljus för att aktivera läkemedlet. SDT tillåter ultraljudet att nå djupare in i vävnaden (till cirka 30 centimeter) jämfört med fotodynamisk terapi (PDT) eftersom det kan vara mycket fokuserat. Detta ökade penetrationsdjup innebär i slutändan att SDT kan användas för att behandla djupare, mindre tillgängliga tumörer och är mer kostnadseffektivt än PDT. Fotodynamisk terapi kan användas i kombination med sonodynamisk terapi och utökas i avsnittet Applikationer i denna artikel. Sonodynamisk terapi kan användas synergistiskt med andra terapeutiska metoder såsom läkemedelsladdade mikrobubblor, nanopartiklar, exosomer, liposomer och gener för förbättrad effektivitet. För närvarande har SDT inga kliniska produkter och fungerar som ett adjuvans för de tidigare nämnda terapeutiska metoderna, men det har undersökts för användning vid åderförkalkning och cancerbehandling för att minska tumörstorleken i bröst-, bukspottkörtel-, lever- och ryggradssarkom.
Handlingsmekanism
Verkningsmekanismen för sonodynamisk terapi är användningen av lågintensivt ultraljud genom användning av fokuserade mekaniska vågor för att skapa en cytotoxisk effekt. SDT i sig är dock icke-termiskt, icke-toxiskt och kan icke-invasivt penetrera djupt in i vävnaden jämfört med andra leveransmetoder såsom fotodynamisk terapi. SDT utförs ofta tillsammans med användningen av en sonosensibilisator som porfyrin , ftalocyaniner , xantener och antitumörläkemedel. Ultraljudsvågor klassificeras också som akustiska vågor, och effekten de har på appliceringsvävnaden kan beskrivas med en process som kallas kavitation. Kavitation uppstår som en specifik interaktion mellan ultraljud och vattenhaltiga omgivningar och orsakar att gasbubblor bryts vid exponering för särskilda ultraljudsparametrar, vilket främjar penetrering av läkemedlet i de biologiska vävnaderna genom att generera håligheter nära membranets kant. Kavitation kan delas upp i stabil och tröghetskavitation. I stabil kavitation gör oscillationen av gasbubblor att miljömedierna blandas. Vid tröghetskavitation ökar gasbubblor i volym och når nästan sin resonansvolym, sväller innan de aggressivt kollapsar. Implosionen av vesikler resulterar i en drastisk temperatur- och tryckförändring, vilket ökar cellmembranets permeabilitet för olika läkemedel. Mikrobubblor skapas av de akustiska vågorna från ultraljudet som expanderar och kollapsar, frigör energi, för sonosensibilisatorn till ett exciterat tillstånd och genererar en ROS. Kavitationen av denna gasbubbla kan bilda ROS med olika metoder som sonoluminescens och pyrolys . Apoptos är resultatet av bildandet av ROS och mekaniska krafter hos SDT genom membranavbrott i en process som kallas lipidperoxidation. Nekros är också ett potentiellt resultat av SDT.
Inverkan av sonoluminescens på SDT och ROS har inte utvecklats helt i litteraturen. För närvarande är det underförstått att sonoluminescens tillåter emission av ljus vid bubbelkollaps vilket kan aktivera sensibilisatorer. En studie av Hachimine et al. lyfter fram användningen av SDT som en metod för att aktivera en låg ljuskänslig sonosensibilisator, DCPH-P-Na(I), för cancer som är för djupt inuti vävnaden för att bekämpa användningen av PDT utan hudirritation. Pyrolys höjer den omgivande temperaturen, förbättrar kavitationsprocessen, bryter ner sensibilisatorn, genererar fria radikaler och de fria radikalerna interagerar i sin miljö för att generera ROS. För båda metoderna har betydelsen av singlettsyren jämfört med hydroxylradikalen för att inducera cytotoxicitet belysts. Medan andra studier har funnit att singletsyren inte har någon betydande effekt. Sammantaget saknar båda dessa metoder betydande bredd i litteraturen för att helt förklara deras roll i ROS-bildning. Litteraturen har dock visat framgång i sin analys och tillämpning.
Sonoluminescens
Två primära mekanismer för ROS-generering finns i sonodynamisk terapi: sonoluminescens och pyrolys. Sonoluminescens uppstår när ultraljud producerar ljus efter bestrålning av en vattenlösning Den exakta mekanismen med vilken ljus produceras är fortfarande oklart. Det föreslås dock att tröghetskavitation är ett nyckelelement för denna process. Andra studier indikerar också den potentiella rollen av stabil kavitation
Pyrolys
Pyrolys tros uppstå när tröghetskavitation inducerar en extrem temperaturökning, bryter ned sonosensibilisatorerna, vilket producerar fria radikaler som kan reagera och i slutändan producera ROS som är nödvändigt för SDT. Den lokala temperaturökningen hjälper till med tröghetskavitationen och nedbrytningen av sonosensibilisatorn för att skapa ROS. Pyrolysen i kavitationsbubblorna kommer att producera H+ och OH- via svag bindning inuti den lösta molekylen.
Lipidperoxidation
Förutom kemiska metoder kan mekaniska egenskaper hos den akustiska våg som genereras från ultraljudet hjälpa till att initiera cytotoxiska effekter. Detta sker genom att membranet störs med en hydrofob sonosensibilisator. Den mekaniska störningen av membranet orsakar en process som kallas lipidperoxidation och justeringar av cellmembranet kan förändra cellläkemedelspermeabiliteten. Både sonokemiska och sonomekaniska metoder används för att generera ROS och frigöra last från vesikler för applikationer som tumörinriktning.
Apoptos
Ultraljud med låg intensitet har inom tidigare litteratur visat sig inducera apoptotiska effekter i omgivande celler. Det har visat sig att det inte är den initiala ROS som orsakar apoptos i cellerna, utan de fria radikalerna i mitokondrierna. I en studie av Honda et al., fastställdes det att mitokondrier-kaspasvägen är ansvarig för apoptos genom ökningen av intracellulärt kalcium. Utanför ROS-inducerad apoptos är kavitation en annan faktor som är involverad i apoptos av omgivande celler. Båda kavitationstyperna kan inducera apoptos genom skada på membranet. Tillstånd som frekvens, arbetscykel, puls och intensitet kan manipuleras för att optimera celldödsförhållanden som nekros, lys eller apoptos.
Autofagi
Denna metod för celldöd kan uppstå genom att cellorganeller blir instängda i autofagosomer som kombineras med lysosomer. Fortsättning av denna process kommer att leda till celldöd och autofaginhibitorer eller promotorer kan kontrolleras för att uppmuntra eller motverka celldöd och upptag av kemoterapeutika.
Sonosensibilisatorer
Sonosensibiliserande medel, eller sonosensibiliserande terapeutika, är den primära delen av SDT och kan skräddarsys för att behandla olika cancerformer och generera olika effekter. Dessa terapier, som ofta involverar användning av porfyrin eller xanten, kommer att initiera en toxisk effekt via ROS vid exponering för ultraljud.
Porfyrinbaserade sensibilisatorer
Porfyrinbaserade sensibilisatorer, som ursprungligen användes som fotosensibilisator i PDT, är ganska hydrofoba molekyler som härrör från hematoporfyrin. Enstaka syreatomer eller hydroxylradikaler produceras av porfyrinbaserade sensibilisatorer vid exponering för ultraljud eller ljus, vilket ger de cytotoxiska effekter som önskas med sonodynamiska och fotodynamiska terapier. Resultatet av porfyrinbaserade sensibilisatorer är dock inte så lokalt som önskat för sonodynamisk terapi eftersom de också är lokaliserade i icke-riktad vävnad mellan tumören och ultraljudssändaren.
Xantenbaserade sensibiliseringsmedel
Xantenbaserade sensibilisatorer, å andra sidan, har visat framgångsrik cytotoxicitet in vitro genom att producera reaktiva syreämnen efter att ha utlösts av ultraljud. Mer forskning är nödvändig för att förbättra dess potential in vivo-prestanda eftersom det snabbt bearbetas av levern och rensas från kroppen. Rose Bengal är en vanlig xantenbaserad sonosensibilisator.
Ytterligare sensibiliseringsmedel
Andra sensibilisatorer som har undersökts för sin potential i sonodynamisk terapi (och som också har använts tidigare i PDT) inkluderar akridinorange , metylenblått , curcumin och indocyaningrönt . En studie av Suzuki et al. använde akridin orange, ett fluorescerande katjoniskt färgämne som kan infoga sig självt i nukleinsyror, för att behandla sarkom 180-celler med ultraljud och visade att reaktiva syrearter är en kritisk del av SDT med tanke på att deras frånvaro minskade effekten av SDT. I likhet med den tidigare studien, en färsk studie av Komori et al. använde ultraljud i kombination med metylenblått (ett fenotiazinfärgämne som vanligtvis används i PDT som uppvisar låg toxicitet) för att bestråla sarkom 180-celler och fann att metylenblått var en effektiv sonosensibilisator för att minska cellviabiliteten. Intressant nog är curcumin en krydda som också kan fungera som en sensibilisator för PDT och SDT. I en studie av Waksman et al., kunde curcumin påverka makrofager, som är viktiga för utvecklingen av plack som finns hos patienter med ateroskleros, och därmed minska mängden plack i en djurmodell. Dessa fynd tillsammans med annan forskning indikerar att curcuminsensibilisatorer kan användas i SDT-cancerbehandlingar. Indocyaningrönt är ett färgämne som absorberar nära infraröda våglängder och är en annan sensibilisator som har visat sig minska cellviabiliteten i kombination med ultraljud och/eller ljus. En in vivo-studie visade att behandling av en mustumörmodell med indocyaningrönt i kombination med ultraljud och ljus resulterade i en 98% minskning av tumörvolymen med 27 dagar efter behandling.
| namn | Strukturera |
|---|---|
| Ftalocyanin | |
| Indocyanin grön | |
| Fenotiazin | |
| Curcumin-keto | |
| Curcumin-enol |
Bärare
Som tidigare nämnts används sonosensibilisatorer ofta i kombination med olika läkemedelsbärare såsom mikrobubblor, nanobubblor, liposomer och exosomer för att förbättra koncentrationen och penetrationen av terapeutiska medel.
Liposomer
Liposomer är en vanlig vehikel vid läkemedelstillförsel och specifikt för behandling av cancer. Liposomer innehåller ett fosfolipiddubbelskikt. Det är utbrett på grund av dess förmåga att penetrera läckande kärlsystem och dålig lymfdränage i tumörer för förbättrad permeabilitetsretention. Dessa läkemedelsbärare kan kapsla in hydrofoba och lipofila molekyler i deras lipiddubbelskikt och kan tillverkas naturligt eller syntetiskt. Dessutom kan liposomer fånga hydrofila molekyler i sin hydrofila kärna. Jämfört med den vanliga cancerbehandlingen kemoterapi tillåter läkemedel som laddas i liposomer minskad systemisk toxicitet och en potentiell ökning av effektiviteten av riktad leverans. Framgång med liposomer som läkemedelstillförselsystem har visats både in vivo och in vitro. En studie av Liu et al. visade att liposomer kan användas tillsammans med SDT för att utlösa frisättningen av läkemedel via oxidation av lipidkomponenterna. En annan studie av Ninomiya et al. utnyttjade nanoemulsionsdroppar exponerade för ultraljudsvågor för bildandet av större gasbubblor för att störa liposommembranet för läkemedelsfrisättning. Många egenskaper och beståndsdelar hos liposomer kan förändras för deras specifika syfte och för att öka effektiviteten, särskilt deras förmåga att resa i blodet och interagera med celler och vävnader i kroppen. Dessa element inkluderar deras diameter, laddning, arrangemang, såväl som sammansättningen av deras membran. Dai et al. föreslog inkorporering av sonosensibilisatorer med liposomer för att förbättra målspecificiteten. Eftersom SDT stimulerar cancervävnader att absorbera och behålla sonosentizers följt av aktivering med extrakorporealt ultraljud, Dai et al. undersökte effekten av liposominkapslade läkemedel på effektiviteten av riktad leverans vid SDT. De fann att, utöver dess bekvämlighet och praktiska egenskaper, är SDT ett säkert och effektivt alternativ för att behandla cancer.
Exosomer
Exosomer är nanobärare som kan ge riktad läkemedelsleverans av terapeutika för att förstärka lokala cytotoxiska effekter och samtidigt minimera eventuella systemiska effekter. De förvärvas från celler och används för transportändamål inom cellen som membranbundna vesiklar. Fördelarna med exosomer för läkemedelsleveransändamål inkluderar deras förmåga att manipuleras och manipuleras, förutom deras låga toxicitet och immunogenicitet. De har också inspirerat forskning kring icke-cellbaserade behandlingsmetoder för olika cancerformer och sjukdomar. Andra önskvärda aspekter av exosomer inkluderar deras totala biokompatibilitet och stabilitet. En studie av Nguyen Cao et al. undersökte användningen av exosomer för leverans av indocyaningrönt (ICG), en sonosensibilisator för behandling av bröstcancer. Signifikant ökad generering av reaktiva syrearter observerades i bröstcancerceller behandlade med folsyrakonjugerade exosomer. Detta är ett exempel på en sonosensibilisator som används för att behandla en specifik cancer med sonodynamisk terapi. Ett annat exempel på exosombaserad sonodynamisk terapi illustrerades av Liu et al. I denna studie dekorerades exosomer med porfyrinsensibilisatorer och detta system användes med en extern ultraljudsenhet för att kontrollera och rikta läkemedelsleverans genom SDT. Liu et al. tillhandahållit en icke-invasiv metod för att behandla cancer genom extrakorporeal aktivering av exosomer genom ultraljud.
Mikrobubblor
På grund av deras förmåga att oscillera vid exponering för lågfrekvent ultraljud har mikrobubblor använts som kontrastmedel för att visualisera vävnader i vilka mikrobubblorna har trängt igenom. Men när dessa mikrosfärer utsätts för ultraljud med högre tryck, kan de brista, vilket kan vara fördelaktigt för läkemedelsleveransändamål. Genom SDT kunde dessa mikrobubblor selektivt sprängas i tumörens mikromiljö för att minska systemiska nivåer av det inkapslade läkemedlet och öka den terapeutiska effekten. Vid applicering av SDT leder ökningen av det akustiska trycket till tröghetskavitationen, eller kollaps av mikrobubblan och lokal frigöring av lasten inuti. Den tröga kavitationen av mikrobubblorna när de utsätts för SDT kallas också för ultraljudsmedierad mikrobubblor (UMMD). Skalet av mikrobubblor kan dekoreras med olika komponenter, inklusive polymerer, lipider eller proteiner beroende på deras avsedda syfte. Mikrobubblor har också använts för lokaliserad frigöring av ansluten last. Denna last är vanligtvis kemoterapeutika, antibiotika eller gener. Olika läkemedel kan laddas direkt in i mikrobubblan med metoder som konjugering och nanopartikel, liposomladdning och gener. Kombinationen av gener och SDT kallas sonotransfektion. Exempel på yttre skalmodifikationer kan ses i en studie av McEwan et al. som fann att lipidmikrobubblor visade minskad stabilitet när sonosensibiliserande medel sattes till deras skal. Att fästa polymeren polymjölk-ko-glykolsyra (PLGA) på skalet resulterade emellertid i ökad stabilitet jämfört med lipidmikrobubblorna utan att förlora andra önskvärda egenskaper såsom målinriktad leverans och selektiv cytotoxicitet. I en annan studie, McEwan et al. undersökte förmågan hos mikrobubblor som bär syre att öka produktionen av reaktiva syrearter, som är en nödvändig komponent i SDT, i den hypoxiska miljön hos många solida tumörer. Dessa mikrobubblor stabiliserades med lipider och en Rose Bengal sonosensibilisator fästes på ytan för att behandla pankreascancer. Deras arbete visade att koppling av syrebelastade mikrobubblor som är känsliga för ultraljud med sonosensibiliserande läkemedel kan möjliggöra ökad läkemedelsaktivering vid det önskade målet även om hypoxi är närvarande. Exempel på terapeutika som har laddats i mikrobubblor är gemcitabin, paklitaxel nanopartiklar, plasmid-DNA och 2,2'-azobis[2-(2-imidazolin-2-yl)propan]dihydroklorid laddade liposomer. På grund av den målinriktade karaktären hos de ligander som är anslutna till mikrobubblan, möjliggör den kontrollerad och specifik målinriktning av den önskade vävnaden för behandling. En annan studie utförd av Nesbitt et al. har visat förbättrad tumörreduktion när gemcitabin laddades i mikrobubblan och applicerades på en human pankreascancer-xenograftmodell med SDT.
Nanobubblor
I likhet med mikrobubblor har nanobubblor visat effekt vid SDT. Men på grund av sin mindre storlek kan nanobubblor nå mål som mikrobubblor inte kan. Nanobubblor kan nå djupare vävnader och passera kärlsystemet. Tidigare forskning har visat att nanobubblor är mer kapabla att nå tumören eftersom de kan tränga igenom endotelceller och migrera bort från kärlsystemet. En studie av Nittayacharn et al. utvecklat doxorubicin-laddade nanobubblor och parat dem med porfyrinsensibilisatorer för att användas i SDT för behandling av bröst- och äggstockscancerceller in vitro. De fann en nästan 70 % ökning av cytotoxicitet när man använde SDT jämfört med endast perfluorpropan-nanobubblor fyllda med iridium(III). Dessutom, jämfört med tomma nanobubblor och/eller fritt iridium(III), observerade de störst generering av reaktiva syreämnen i iridium(III)-nanobubblor som exponerades för ultraljud. Dessa resultat visar att nanobubblor laddade med en sonosensibilisator och exponerade för ultraljud kan vara en potentiell effektiv behandling för cancer med SDT. Precis som med mikrobubblor har nanobubblor också visat sig lovande som syreavgivande vesiklar för att förbättra effektiviteten av SDT. För att lindra hypoxi i målvävnad, Owen et al. använde en gnagarmodell för pankreascancer för att leverera fosfolipidstabiliserade nanobubblor fyllda med syre. Mössen delades in i grupper, en som fick syrefyllda nanobubblor före injektion av en sonosensibilisator och en som inte gjorde det. En statistiskt signifikant skillnad mellan nivåerna av syre i tumörerna i de två grupperna observerades, vilket tyder på att nanobubblor kan vara ett effektivt tillägg till SDT för att behandla cancer i en hypoxisk miljö.
Ansökningar
Kombination med andra terapier
Sonodynamisk terapi kan kombineras med andra terapeutiska tekniker för att förbättra behandlingens effektivitet för olika typer av cancer och sjukdomar. SDT kan kombineras med fotodynamisk terapi, kemoterapi, strålning, MRT och immunterapi. PDT har ofta använts i kombination med SDT eftersom sonosensibilisatorer också är ljuskänsliga. Under den initiala utvecklingen av SDT har Umemura et al., bestämt att hematoporfyriner kunde initiera celldöd på samma sätt som PDT. Detta beror på att SDT kan initiera sonoluminescens. Fördelen med SDT framför PDT är dock att den kan penetrera djupt och exakt in i målvävnaden. I en studie av Lui et al., visades det att användning av en kombination av dessa två tillförselmetoder resulterar i ökad cytotoxicitet med sinoporfyrin i en metastatisk xenotransplantatmodell. I ett annat exempel på att kombinera SDT med PDT, visade Borah et al. undersökte fördelen med 2-(1-hexyloxietyl)-2-devinylpyrofeoforbid-a (HHPH), ett fotodynamiskt terapiläkemedel, som en sonosensibilisator och en fotosensibilisator för behandling av glioblastom. Kombinationen av dessa terapier visade ökad celldöd/tumörrespons, möjligen orsakad av synergistiska effekter.
Målet med en studie av Browning et al. var att undersöka den potentiella förbättringen av kemoradiationseffektivitet genom att kombinera den med sonodynamisk terapi hos patienter med pankreascancer. I en modell ökade överlevnaden med kombinationen jämfört med enbart chemoradiation. Skillnader i resultaten för de två olika modellerna kan hänföras till variationer i tumörorganisation. De tumörer som visade den största minskningen i storlek var mindre vaskulariserade, vilket kanske gjorde dem mer sårbara för SDT. En annan studie av Huang et al. använde element av mesoporösa organosilika-baserade nanosystem för att tillverka en sonosensibilisator som ska användas med MRI-styrd SDT. Ökad celldöd och hämmande av tumörtillväxt inducerades av sonosensibilisatorerna, vilket indikerar hög SDT-effektivitet. Detta visar hur SDT kan hjälpa till med både avlägsnande och hämning av tumörtillväxt.
SDT har också kombinerats med immunterapi. En studie av Lin et al. syftade till att använda kaskad immuno-sonodynamisk terapi för att förbättra tumörbehandling med antikroppar. Nanosonosensibilisatorerna resulterade i hög effektivitet i läkemedelsladdningen och ett tumörspecifikt adaptivt immunsvar. Detta tjänar som ett exempel på hur SDT kan kombineras med checkpoint blockad immunterapi för att öka effektiviteten i cancerbehandlingar. En annan studie av Yue et al. strävade efter att kombinera checkpoint-blockad immunterapi med nanosonosensibilisatorer-förstärkt icke-invasiv sonodynamisk terapi. Tillsammans med hämmande av lungmetastaser främjade denna kombination ett antitumörsvar som förbjöd tumörtillväxt. Detta ger ett proof-of-concept för att kombinera SDT med en annan terapi för att förbättra behandlingseffekterna på kort och lång sikt.
Typer av cancer SDT har visat sig behandla
Cancer behandling
Behandlingen av många olika typer av cancer har undersökts med användning av sonodynamisk terapi både in vitro och/eller in vivo inklusive glioblastom, pankreascancer, bröst-, äggstockscancer, lung-, prostatacancer, lever-, mag- och koloncancer. En studie av Gao et al. visade att SDT är kapabelt att hämma angiogenes genom produktion av ROS. Detta hindrade proliferation, migration och invasion av endotelceller, tumörtillväxt, intratumoral vaskularitet och uttryck av vaskulär endoteltillväxtfaktor inom tumörcellen i xenograft-råttmodeller. Hachimine et al. utförde en stor in vitro-studie där SDT testades på sjutton olika cancercellinjer. De typer av cancer som inkluderades var cancer i bukspottkörteln, bröst, lungor, prostata, lever, mage och tjocktarm. Den mest framgångsrika behandlingen var den av lungcancer med 23,4 % cellviabilitet efter behandling. Qu et al. syftade till att utveckla en "allt-i-ett" nanosensibiliserande plattform utlöst av SDT som kombinerar olika diagnostiska och terapeutiska effekter för att behandla glioblastom. Apoptos inducerades framgångsrikt och mitofagi hämmades i gliomceller. Detta är ett exempel på hur SDT kan användas med en annan plattform för att behandla glioblastom. Borah et al., som nämnts ovan, undersökte också förmågan hos SDT (och PDT) att behandla glioblastom och fann att SDT (kombinerat med PDT) kunde öka antalet dödade tumörceller. McEwan et al. och Owen et al. båda visade användningen av mikro/nanobubblor för att öka syrekoncentrationen nära hypoxiska bukspottkörteltumörer, och därigenom öka effektiviteten av SDT.
Bröstcancer
12% av kvinnorna i USA kommer att få diagnosen bröstcancer . Metastaser och återfall är en stor utmaning för djupt sittande solid state-tumörer. SDT utforskas för närvarande som en behandlingsmetod för bröstcancer, samtidigt som man undviker de biverkningar som är förknippade med nuvarande terapeutiska metoder. Det har visats framgång med att använda SDT i kliniska försök på djur och människor för att minska tumörstorleken genom mitokondriell inriktning för att initiera apoptos av tumörceller och autofagi och immunsvarsreglering. Det finns dock fortfarande komplikationer med korrekt terapeutisk effekt när det används ensamt.
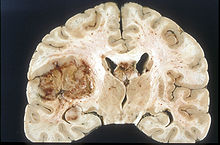
Gliom
Malignt gliom är en extremt svårbehandlad hjärntumör som är en ledande dödsorsak över hela världen och hälften av cancerrelaterade dödsfall. Komplikationer i samband med behandling av gliom inkluderar blod-hjärnbarriären (BBB). Denna skyddsmekanism för hjärnan skapar också utmaningar för läkemedelsleverans genom de täta förbindelserna mellan endotelceller, vilket endast tillåter små lipidlösliga läkemedel (<400 Da) att tränga igenom. Nuvarande leveransmetoder är kirurgi och kemoterapi. SDT har implementerats som en metod för att öppna BBB och har visat framgång med att öppna täta korsningar för leverans. Exempel på sonosensibilisatorer som har visat framgång vid behandling av gliom är hematopor-fyrinmonometyleter (HMME), porfimernatrium (Photofrin), di-sulfo-di-ftalimidometylftalolcyaninzink (ZnPcS2P2), Photolon, 5-aminolevulinsyra (5-ALA), och rose bengal (RB). Dessa har visat sig inducera effekter såsom öppning av BBB, förbättrad vaskulär permeabilitet och apoptos av gliomceller.
Prostatacancer
Prostatacancer är den andra orsaken till cancer och den vanligaste maligniteten i samband med dödsfall hos män över hela världen. Nuvarande behandlingsmetoder är invasiv resektionsterapi, strålbehandling och prostatektomi som kan orsaka komplikationer som inkontinens, impotens och skador på omgivande organ och vävnader. Aktuella studier har visat framgång med att använda SDT som en fristående behandling. SDT använder mitokondrierelaterad apoptos för att minska cellviabiliteten. SDT för behandling av prostatacancer har också använts tillsammans med kemoterapeutika som docetaxel-mikrobubblor. Detta har visat sig förstärka effekterna av docetaxel genom en minskning av tumörperfusion och ökad nekros och apoptos. SDT- och docetaxelgruppen visade minskning av tumörtillväxt. Sammantaget har användningen av SDT visat lovande resultat vid behandling av prostatacancer.
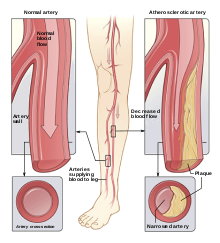
Arteriella sjukdomar
Sonodynamisk terapi kan användas för att behandla mer än bara cancer. Ateroskleros , som är en kronisk artärsjukdom, är ett annat mål som har observerats i litteraturen. Denna sjukdom uppstår när fettplack samlas på den inre ytan av artären och kan orsakas av fel i lipidmetabolismen. Närmare bestämt orsakas ateroskleros av en ökning av endotelpermeabiliteten som gör att lipoproteinpartiklar med låg densitet blir oxiderade och genomgår sedimentering. Dessa lipoproteiner orsakar en ökning av makrofager och leder till intensifierad plackuppbyggnad. Som ett resultat är det höga inflödet av makrofager målet för AS-behandling för att bromsa plackuppbyggnaden. Vid sidan av förhållandet mellan plackuppbyggnad och makrofager förvärrar monocyternas differentiering till makrofager den tidigare nämnda processen förutom att den orsakar inflammation.
En studie av Wang et al. syftade till att förstå de underliggande mekanismerna angående den potentiella effekten av icke-dödlig SDT på ateroskleroiska plack. Det fastställdes att icke-dödlig SDT förhindrar plackutveckling. En studie utförd av Jiang et al., visade framgång i SDT genom minskning av makrofaginflammatoriska faktorer som TNF-alfa, IL-12 och IL-1B. De visade också att SDT kunde hämma plackinflammation hos patienter med perifer artärsjukdom och fortsätta att främja positiva resultat i längre än sex månader. Populära sonosensibilisatorer för AS-behandling är protoporfyrin IX (PpIX) och 5-aminolevulinsyra (5-ALA). PpIX används ofta i PDT och genereras genom 5-ALA, en icke ultraljudsaktiverad komponent, genom att öka PpIX-koncentrationen i en cell. En studie av Cheng et al. bestämt att THP-1 makrofagapoptos induceras av en ökning av PpiX-koncentrationen, vilket leder till produktion av stora mängder ROS. Användningen av SDT för AS-behandling har också visat framgång för att främja återpopulationen av vaskulära glatta muskelceller (VMSC) genom att inducera ytterligare uttryck och autofagi för att förhindra VMSC-utveckling till plackhållande makrofager. En studie utförd av Dan et al. visade ökningen i glatt muskel a-aktin, glatt muskel 22a, p38 mitogenaktiverad proteinkinasfosforylering. Medan en studie av Geng et al. visade förbättrad VMSC-autofagi. Var och en av dessa faktorer bidrog till den förbättrade differentieringen och utvecklingen av VMSC.
In vitro och in vivo arbete
In vitro
In vitro-experiment ger stor insikt och kunskap för att karakterisera potentialen för sonosensibiliserande beteende in vivo. Dessutom har SDT visat framgång genom sin låga intensitet som tillåter ökad plasmamembranpermeabilitet utan celldöd. Sonosensibilisatorer har också använts in vitro i applikationer med olika cellinjer och för att ytterligare förstå verkningsmekanismen för celldöd. Det är för närvarande underförstått att PDT och SDT har liknande mekanismer för generering av fria radikaler för att inducera apoptos och nekros. Varje cellinje är dock unik och kan orsaka celldöd med olika effekt. Några exempel på in vitro-arbete inkluderar initiala studier som utfördes av Yumita et al., 1989 som använde hematoprofyrin och SDT för mus sarkom 180 och råtta ascites hepatom (AH) som visade ett samband mellan dosering och ultraljud, och mikrobubblor som orsakade kavitation som leder till cellskador utan användning av droger. Denna studie betonade också skillnaden i effektivitet mellan cellinjer genom att SDT 180 har mindre lys jämfört med AH-130-celler. En annan studie av Hachimine et al. betonade effektiviteten mellan cellinjer genom att undersöka sju olika cancerformer med totalt 17 cellinjer under användning av DCPH-P-NA(I). Denna studie visade att mag- och lungcancerlinjerna av MKN-28 respektive LU65A hade den högsta överlevnaden, men mag- och lungcancerlinjerna av RERFLC-KJ respektive MKN-45 hade de lägsta överlevnadsfrekvenserna. En annan studie av Honda et al., med U937 och K562 visade att sonikering ökar de intracellulära kalciumjonnivåerna respektive minskar GSH-koncentrationen. Denna ökade koncentration av kalcium spelar en betydande roll i celldöd genom DNA-fragmentering och mitokondriella membranavbrott. Medan en minskad koncentration av GSH spelar en betydande roll för att möjliggöra bildandet av fler fria radikaler. En studie av Umemura et al., fann att ATX-70 kontra hematoporfyrin har ökad cytotoxisk aktivitet. Aktuell forskning fokuserar vanligtvis på att använda tumörxenograftmodeller för att bestämma effekten av SDT på målceller och leveranseffektivitet.
In vivo
Bygger på studien av Umemura et al. och ATX-70 fann man att 24 timmar efter administrering av sonosensibilisatorn hade förbättrad effekt när ultraljud applicerades jämfört med omedelbar administrering. Det fastställdes också att de flesta ultraljudsfrekvenser sträcker sig mellan 1-3 MHz och 0,5-4W/cm^2. Högre frekvenser vid värden som 20W/cm^2 och 25W/cm^2 resulterade i stora nekrotiska lesioner. Detta etablerade ett samband mellan sonosensibiliserande formulering och ultraljudsintensitet till nekros. Andra studier har fortsatt att förnya detta genom att kontrollera läkemedelsultraljudsintervall (DUI) för olika sonosensibilisatorer för att bestämma den optimala tidsperioden för att applicera ultraljudet för förbättrad effekt. Dessutom har det visat sig att SDT kan störa omgivande kärlsystem i tumörer. Detta har visats i studier av Gao et al. med 5-ALA i möss och humana navelvenendotelcellinjer genom hämning av mikrokärldensitet och cellproliferation, migration och invasion.
Utmaningar och utveckling
En av de många fördelarna med SDT jämfört med PDT är förmågan hos SDT att penetrera djupt placerade solida tumörer vilket möjliggör ett bredare behandlingsområde. Trots detta faktum finns det begränsningar för SDT som måste övervinnas eller ha optimerade komponenter för att utöka effekten och tillämpningen av SDT. SDT tillåter visserligen exakt aktivering av det terapeutiska medlet, men är begränsad i leveransen och ackumuleringen av leveransmodaliteten för att penetrera djupt in i det önskade tumörstället. Detta tillgodoses ofta genom leveranskärl såsom nanopartiklar eller liposomer. Men nanomedicin begränsas av den förbättrade permeabiliteten och retentionseffekten och kämpar för att leverera i riktat överflöd beroende på leveransvesikeln. Detta kan ses i nanopartiklar som kämpar med ospecifik leverans. Framtida forskning har fokuserats på att utveckla höginriktade och penetrerande nanopartiklar för förbättrad leverans och farmakokinetik. På grund av den komplexa naturen hos tumörer och deras mikromiljöer är de svåra att behandla med endast en terapi. För att förbättra den ofta låga produktionen av reaktiva syrearter för att hantera den hypoxiska tumörmiljön, kan SDT kombineras med andra terapier, såsom PDT, kemoterapi och immunterapi för att förbättra patientresultaten. SDT ensamt svarar inte bra i hypoxiska miljöer. Bioreduktiv terapi skulle dock kunna användas för att minska effekten av SDT:s begränsningar avseende hypoxi i tumören samtidigt som frisk/normal vävnad lämnas ensam. Sonosensibilisatorer kräver också kontinuerliga höga nivåer av syre för att skapa ROS, som inte är lättillgängligt i en hypoxisk tumörmikromiljö. Emellertid har strategier som syrgastillskott och produktion för att tillföra det nödvändiga syret och förbättra kavitationen och glutationutarmning för att undvika minskningen av de fria radikalerna som produceras implementerats tillsammans med sonosensibilisatorer för att tillföra det nödvändiga syret eller minska den stridande funktionen. Förutom sin relativt låga generering av reaktiva syrearter kan SDT också orsaka permanent förstörelse av normala vävnader. Denna brist på selektivitet orsakas av ultraljudsdivergens, vilket resulterar i värme och skjuvning som påverkar vävnader utanför målet. Även om fördelar med organiska sonosensibilisatorer finns, såsom hög reproducerbarhet, biokompatibilitet, produktion av reaktiva syrearter, har de också begränsningar. Faktorer som begränsar översättningen av organiska sensibilisatorer till kliniska tillämpningar inkluderar låg vattenlöslighet, sonotoxicitet och målbarhet samt hög fototoxicitet . Andra egenskaper skulle kunna främja snabb clearance av läkemedlet, varför olika nano- och mikropartiklar används för att transportera läkemedlet till önskad plats. Dessutom kräver sonosensibilisatorer i SDT ofta ökad dos, och förhållandet mellan terapeutisk dos och toxicitet för sonosensibilisatorer har inte karakteriserats ordentligt tillsammans med andra variabler såsom vävnadstyp och akustiskt tryck. Oorganiska sensibilisatorer producerar reaktiva syreämnen, men i lägre koncentrationer än vad som är önskvärt för SDT, vilket begränsar deras förmåga att användas i en klinisk miljö. En annan utmaning återspeglas in vitro och in vivo arbete. Ett exempel på detta kan ses i en studie med rosenbengal, ett xantenfärgämne. Det visade sig vara framgångsrikt in vitro, men in vivo visade signifikant mindre effekt på grund av leverupptagning och clearance. Slutligen finns det inga nuvarande standardiserade datorsimuleringar för att förutsäga egenskaperna hos olika sonosenibilisatorer i vävnad, vilket skulle ge ytterligare insikt om hur sonosensibilisatorer kan bete sig.
Aktuell klinisk användning
SDT har forskats mest för att bekämpa cancer och åderförkalkning som bröstcancer, bukspottkörtelcancer, lever och ryggradssarkom. För närvarande finns det inga FDA-godkända kliniska tillämpningar av SDT. Men för PDT Photofrin ett FDA-godkänt hematoporfyrin (PHOTOFRIN®). SDT har dock använts i en klinisk prövning i kombination med PDT för att bedöma minskning av tumörstorlek hos patienter med bröstcancer. Det var dock svårt att avgöra om SDT PDT eller läkemedelsdosen var den primära behandlingsmekanismen. En annan fallstudie utökade detta genom att använda SDT som en fristående behandling med en Gc-proteinhormonbehandling med användning av 5-ALA eller klor e6 som sonosensibilisator. Det visades att tumörmarkörer minskade signifikant under behandlingen.
Framtida inriktningar

Effektiviteten av sonodynamisk terapi som cancerbehandling stöds av många in vitro- och in vivo-studier. Storskaliga kliniska prövningar är emellertid nödvändiga för översättning till den kliniska miljön. För att mildra de ovan nämnda begränsningarna utvecklas nya sonosensibilisatorer och SDT kombineras med andra terapier på nya sätt. I synnerhet behöver organiska sonosensibilisatorer med hög löslighet i vatten, hög sonotoxocity, ökad förmåga att rikta in sig på tumörer och låg fototoxicitet utvecklas för att förbättra den terapeutiska effekten av SDT och göra det möjligt att använda det för behandling av cancer. Dessutom är mekanismerna genom vilka ROS produceras av sonosensibilisatorer vid exponering för ultraljud ännu inte fastställda, vilket minskar förmågan att kontrollera dess funktion och resultat. I slutändan skulle de synergistiska effekterna av att kombinera SDT med andra terapier tillåta var och en att kompensera för den andras begränsningar, förbättra deras terapeutiska effektivitet och öka deras förmåga att förstöra tumörer.