Shi-epoxidation
| Shi-epoxidation | |
|---|---|
| Döpt efter | Yian Shi |
| Reaktionstyp | Ringbildande reaktion |
| Identifierare | |
| Organic Chemistry Portal | |
| RSC ontologi-ID | |
Shi -epoxidationen är en kemisk reaktion som beskrivs som den asymmetriska epoxideringen av alkener med oxon (kaliumperoximonosulfat) och en fruktos -härledd katalysator ( 1 ). Denna reaktion tros fortgå via en dioxiranmellanprodukt , genererad från katalysatorketonen av oxon (kaliumperoximonosulfat). Tillsatsen av sulfatgruppen av oxonen underlättar bildningen av dioxiranen genom att fungera som en bra lämnande grupp under ringslutning. Det är anmärkningsvärt för sin användning av en icke-metallkatalysator och representerar ett tidigt exempel på organokatalys . Reaktionen upptäcktes först av Yian Shi (史一安, pinyin : Shǐ Yī-ān) från Colorado State University 1996.
Historia
Många försök till syntes av en effektiv icke-metallkatalysator gjordes innan en upptäcktes. Problemet med tidigare katalysatorer var den snabba nedbrytningen/oxidationen av dioxiranmellanprodukten och avsaknaden av elektrofilicitet hos den reaktiva ketonen. Aromatiska ketoner föreslogs, och många efterföljande varianter av oxoammoniumsalter användes, men var ineffektiva för att främja epoxidation på grund av den oxidativa instabiliteten hos amidgrupperna och hög flexibilitet hos de sju-ledade ringarna. Enantioselektiviteten för dessa tidiga katalysatorer sänktes också på grund av stora avstånd mellan de asymmetriska subenheterna och reaktionscentra, vilket gav mindre än 10 procent i enantiomert överskott .
Katalysatorn som upptäcktes av Yian Shis grupp 1996 härrörde från D-fruktos och har ett stereogent centrum nära det reagerande centrumet (keton) - den stela sexledade ringstrukturen hos katalysatorn och den intilliggande kvartära ringgruppen minimerar epimeriseringen av detta stereocentrum . Oxidation av den aktiva dioxirankatalysatorn sker från si-ytan , på grund av steriskt hinder av den motsatta baksidan. Denna katalysator fungerar effektivt som en asymmetrisk katalysator för ofunktionaliserade transolefiner.
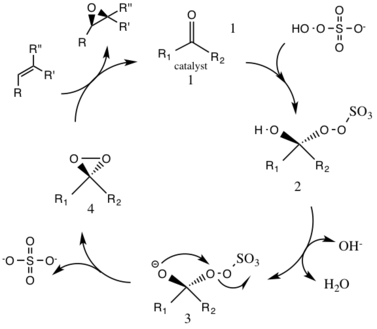
Bildning av dioxirankatalysator
Under normala pH-förhållanden behövs ett överskott av 3 stökiometriska mängder ketonkatalysator på grund av en hög nedbrytningshastighet. Vid grundläggande pH-förhållanden större än 10 (pH 10,5) behövs substökiometriska mängder (0,2–0,3) för epoxidationer, vilket minskar nedbrytningen av reagenser genom att missgynna Baeyer-Villiger-bireaktionen. Högre temperaturer resulterar i ytterligare nedbrytning; sålunda används en låg temperatur på noll grader Celsius.
Nedbrytning av reagenser är bimolekylär ( andra ordningens reaktionshastighet ), så låga mängder oxon och katalysator används.
Reaktionen förmedlas av en D-fruktos-härledd katalysator, som producerar (R,R)-enantiomeren av den resulterande epoxiden. Lösligheten av olefinorganiskt substrat och oxidationsmedel (oxon) skiljer sig åt, och därför behövs ett tvåfasiskt medium. Genereringen av den aktiva katalysatorn sker i det vattenhaltiga skiktet och skjuts till det organiska skiktet med reaktanterna med tetrabutylammoniumsulfat. Ketonkatalysatorn regenereras kontinuerligt i en katalytisk cykel och kan således katalysera epoxidationen i små mängder.
Det första steget i den katalytiska cykelreaktionen är den nukleofila additionsreaktionen av oxonen med ketongruppen på katalysatorn (mellanprodukt 1). Detta bildar den reaktiva intermediära nummer 2-arten, Criegee-intermediären som potentiellt kan leda till oönskade sidoreaktioner, såsom Baeyer-Villiger-reaktionen (se nedan). Genereringen av intermediär art nummer 3 sker under basiska betingelser, med ett avlägsnande av vätet från hydroxigruppen för att bilda en nukleofil syreanjon. Sulfatgruppen underlättar den efterföljande bildningen av dioxiranen, intermediär art nummer 4, genom att fungera som en bra lämnande grupp under 3-exo-tet- cykliseringen. Den aktiverade dioxirankatalytiska arten överför sedan en syreatom till alkenen, vilket leder till en regenerering av den ursprungliga katalysatorn.
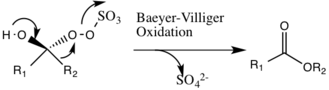
Sidereaktioner
En potentiell bireaktion som kan inträffa är Baeyer-Villiger -reaktionen av intermediär 2, där det sker en omarrangering av peroxigruppen som resulterar i bildningen av den relativa estern. Omfattningen av denna sidoreaktion minskar med stigande pH och ökar nukleofilicitet hos oxonen, vilket gör grundläggande förhållanden gynnsamma för den totala epoxidationen och reaktiviteten hos de katalytiska arterna.
Epoxidationsmekanismer
från kan förekomma dioxirangruppen som genereras på den organiska katalysatorn överförs till alkenen, i vad som anses vara en samordnad mekanism, även om närvaron av en syreanjon-mellanprodukt genom en Sn2-mekanism .
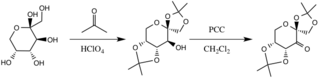
Framställning av D-fruktosderivat
Katalysatorn bildas genom reaktion med aceton under basiska betingelser, med hydroxylgrupperna i fruktosringen som fungerar som nukleofiler, deras nukleofilicitet ökas av de grundläggande förhållanden som skapas av kaliumkarbonat . De elektronavdragande substituenterna (alfa-etergrupper) uppmuntrar bildningen av ketonen från oxidationsmedlet pyridiniumklorkromat genom att öka elektrofilicitet hos karbonylkolet, via en stabiliserande delokalisering av de bildande π CC-bindningarna till σ* CO-bindningarna i intilliggande etrar.
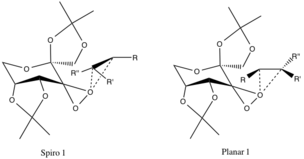
Övergångstillstånd och enantiomer selektivitet
Det finns två föreslagna övergångstillstånd, vars geometrier spekuleras och inte bekräftas av experimentella bevis, men tillskrivs stereoelektroniska effekter . Spiroövergångstillståndet gynnas framför det plana på grund av att det överlägsna syrets icke-bindande orbitaler donerar till π* antibindande CC-orbitaler i den reagerande alkenen, vilket ger en stabiliserande delokalisering av elektroner.
Donation av dessa elektroner till de bildande CO σ-bindningarna i epoxidbindningarna uppmuntrar också bildningen av spiroprodukten (produktens geometri är också inriktad). Den plana konfigurationen är ogynnsam på grund av bristen på pi-backbonding och steriskt hinder av alkylgrupperna med stora alkylfunktionella grupper i den katalytiska ringen.
De tidigare nämnda konfigurationerna gynnas framför övergångstillstånden för de motsatta enantiomererna på grund av ogynnsamma steriska interaktioner mellan R-alkylgrupperna (se nedan) och de eter-alkylfunktionella grupperna i katalysatorringen.
Den enantiomera framgången för denna epoxidation är relativt hög jämfört med metallkatalysatorer och resulterar i allmänhet i ett högt enantiomert överskott som överstiger 80 procent.
Reaktionsutbyte och stereoselektivitet
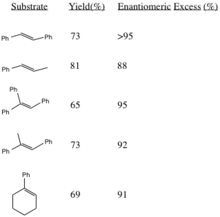
Denna procedur genererar epoxider med höga enantiomera överskott från trans-disubstituerade alkener och trisubstituerade alkener. Cis-disubstituerade alkener och styrener epoxideras asymmetriskt med användning av en liknande katalysator. Generering av (R,R)-epoxider från motsvarande alkener ökar i stereoselektivitet med ökad sterisk bulk av substituent R-grupper (särskilt i trans-olefiner).
Se även
- ^ En effektiv katalytisk asymmetrisk epoxidationsmetod Zhi-Xian Wang, Yong Tu, Michael Frohn, Jian-Rong Zhang och Yian Shi J. Am. Chem. Soc. 1997 , 119(46) , 11224-11235. ( doi : 10.1021/ja972272g )
- ^ Frohn, M.; Shi, Y. Synthesis 2000 , 14 , 1979-2000 doi : 10.1055/s-2000-8715 . (Recension)
- ^ Tian, H.; Hon, X.; Shu, L.; Yu, H.; Shi, Y.J. Am. Chem. Soc. 2000 , 122 , 11551-11552. ( doi : 10.1021/ja003049d )
- ^ Tian, H.; Hon, X.; Xu, J.; Shi, Y. Org. Lett. 2001 , 3 , 1929-1931. ( doi : 10.1021/ol010066e )
- Shi-epoxidation < https://www.organic-chemistry.org/namedreactions/shi-epoxidation.shtm >
- Danmark, Wu, et al. "Utvecklingen av kirala, icke-racemiska dioxiraner för den katalytiska, enantioselektiva epoxideringen av alkener". (13 april 1999) < https://www.thieme-connect.de/products/ejournals/pdf/10.1055/s-1999-3123.pdf >
- Frohn, Shi, Tu, Wang, Zhang, et al. "En effektiv asymmetrisk epoxidationsmetod". (8 juli 1997) < http://pubs.acs.org/doi/pdf/10.1021/ja972272g >
- Shi, Wang, et al. "En ny typ av ketonkatalysator för asymmetrisk epoxidation". (12 september 1997). < http://pubs.acs.org/doi/pdf/10.1021/jo971701q >