Paucimannosylering
Inom biokemi är paucimannosylering en enzymatisk posttranslationell modifiering som involverar bindning av relativt enkel mannos (Man) och N-Acetylglukosamin (GlcNAc) innehållande kolhydrater ( glykaner ) till proteiner . De paucimannosidiska glykanerna kan också modifieras med andra typer av monosackarider inklusive fukos (Fuc) och xylos (Xyl) beroende på art, vävnad och cellursprung.
Paucimannosylering bildar en separat undertyp i det asparagin- N-kopplade glykosyleringssystemet . De korta paucimannosidiska glykanerna passar varken strukturellt eller funktionellt in i de tre väletablerade N-glykanklasserna, dvs. oligomannosidic-, hybrid- och komplextyp N-glykaner.
Paucimannosylering har traditionellt hänvisats till som en N-glykosyleringstyp av "lägre organismer", oftast dokumenterad i insekter, maskar och växter. Nya fynd har dock lagt till nyanser till denna uppfattning genom att visa deras närvaro och roller hos däggdjur inom områdena immunitet, cellulär utveckling, patogeninfektion och cancer. För detta ändamål anses därför paucimannosylering nu vara en distinkt typ av N-glykosylering som lägger till mångfald till det mycket heterogena glykoproteomet över den eukaryota domänen.
Etymologi
Termen "paucimannose" (ibland stavat som "pauci-mannos") myntades i början av 1990-talets glykobiologiska litteratur. Paucimannose använder prefixet "pauci" som betyder få eller små på latin och suffixet "mannos" som indikerar glykaner som involverar mannosavslutande glykaner.
Fraserna proteinpaucimannosylering och paucimannosidproteiner används vanligtvis i litteraturen för att beskriva paucimannosmodifierade glykoproteiner som uppvisar intakt strukturell och funktionell integritet. Däremot benämns själva oligosackariderna ofta som paucimannosidic, låg mannos och trunkerade glykaner eller annan mindre konventionell nomenklatur.
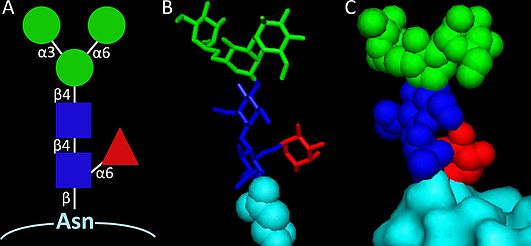
En enkel stenografinomenklatur har föreslagits som ett bekvämt sätt att namnge de individuella paucimannosidic-glykanstrukturerna, t.ex. betecknar M3F Man 3 GlcNAc 2 Fuc 1 .
Vanliga paucimannosidic strukturella egenskaper över arter, vävnad och protein ursprung
Paucimannosidic glykaner spänner över baskompositionen Man 1-3 GlcNAc 2 . Ytterligare modifieringar med Fuc, Xyl och/eller Galaktos (Gal) är vanliga hos däggdjur ref, växter respektive ryggradslösa djur. Paucimannosidic glykaner uttryckta av insekter och nematoder är särskilt rika på strukturell mångfald.
Vävnadsuttryck och (sub-) cellulär lokalisering
Paucimannosylering har studerats och dokumenterats omfattande i insekter, nematoder och växter under de senaste decennierna. De paucimannosidiska proteinerna uttrycks konstitutivt och brett över vävnader i dessa organismer under normal fysiologi. Det är allmänt erkänt att paucimannosylering är en central komponent i glykoproteomet i dessa "lägre" organismer. Nyligen rapporterades paucimannosylering bilda en okonventionell typ av protein N-glykosylering hos ryggradsdjur. Det har föreslagits att "högre" arter inklusive människor, gnagare och andra däggdjur använder paucimannosylering på ett mer vävnads- och kontextbegränsat sätt vid patofysiologiska tillstånd inklusive cancer, patogeninfektion, inflammation och stamness.
Insekter
Paucimannosidic glykaner utgör huvudkomponenten i N-glykomet hos insekter som Drosophila melanogaster . Glykoprofilering av giftkomponenten hos det västra honungsbiet, Apis mellifera , identifierade att paucimannosylering är en vanlig modifiering av nyckelproteiner inklusive hyaluronidas och fosfolipas .
Insektscelllinjer används ofta för rekombinant expression av däggdjursglykoproteiner, som därför är dekorerade med paucimannosidglykaner, t.ex. musinterferon-p, humant IgGi och alkaliskt fosfatas från kalv .
Nematoder
Modellorganismen Caenorhabditis elegans klassificerad under phylum Nematoda är bland de mest studerade ryggradslösa arterna inom glykobiologin. Litteraturen dokumenterar tydligt en repertoar av nematodala paucimannosidic-glykaner. En annan modellnematod, Pristionchus pacificus , dokumenterades också uttrycka vanliga nematodala paucimannosidic-glykaner.
Parasitiska nematoder såsom Haemonchus contortus har rapporterats bära paucimannosidic glykaner konjugerade till ett intestinalt mikrosomalt aminopeptidas. Dessutom har det förekommit rapporter som dokumenterar uttrycket av paucimannosidic glykaner av andra parasitiska nematoder såsom Ascaris suum, Heligmosomoides polygyrus och Trichuris suis.
Växter
De flesta växtarter som hittills studerats är kända för att konstitutivt uttrycka paucimannosidic N-glykoproteiner. De paucimannosidiska N-glykoproteinerna uttrycks rikligt i vakuolerna hos växter, såsom baljväxtfrön från Lotus japonicus , risfrön och blad från Oryza sativa. Litteratur har gett bevis för växtspecifika paucimannosidic-glykanstrukturer modifierade med Xyl och Fuc. Sådana strukturer finns över den breda Streptophyta (landväxter) och Chlorophyta (gröna alger) kladden och i kiselalger som Phaeodactylum tricornutum . Mindre rapporterade bixylosylerade paucimannosidic-glykaner har också dokumenterats.
Ryggradsdjur
Paucimannosidic-proteiner har rapporterats i ryggradsdjur såsom vaktel, kyckling och i däggdjur, vilket omfattar en begränsad mångfald av paucimannosidic-glykanstrukturer. Tidiga fynd rapporterade om paucimannosidglykaner på lysosomala glykoproteiner hos husdjur. och mänskliga vävnader, men har senare visat sig även dekorera icke-lysosomala glykoproteiner. Speciellt är granulerna av humana neutrofiler en huvudkälla för paucimannosidproteiner. Paucimannosidic-proteiner observerades också i humana monocyter och makrofager och paucimannosidic-immunoglykopeptider visade sig presenteras av SARS-CoV-2-utmanade dendritiska celler. Arter inom andra klasser under Animalia relaterade till ryggradsdjur dokumenterades också uttrycka paucimannosidproteiner. med några observationer av ovanliga växt- och ryggradslösa paucimannosidiska glykanstrukturer
Svampar
Trots att den fått avsevärt fokus innehåller den glykobiologiska litteraturen inte bevis för närvaron av paucimannosidproteiner i svampar. Svamparter inom detta kungarike anses därför sakna proteinpaucimannosylering och bär istället höga mannosylerade N-glykoproteiner innefattande förlängda och grenade mannosdekorerade antenner.
Biosyntes av paucimannosidic N -glykoproteiner
Vanliga aspekter av biosyntesen av paucimannosidic glykoproteiner över arter
I likhet med andra N -kopplade glykantyper har biosyntesen av paucimannosidicproteiner i de flesta arter dokumenterats underlättas av verkan av en begränsad uppsättning glykoenzymer inklusive beta-N-acetylhexosaminidaser ( Hex ) och alfa-mannosidaser , genom GnT-I-beroende och -oberoende trunkeringsvägar.
Insekter
Studier på insektscellinjer och in vivo-experiment på D. melanogaster har avslöjat aktivt uttryck av Hexo1 och Hexo2, och, viktigast av allt, genen för fusionerad lob (fdl) som kodar för fusionerad ß-lob (FDL), även känd som GNase, en ortolog av A. thaliana och mänsklig Hex. FDL uttrycks i hög mängd i vesiklar och plasmamembranet och har, till skillnad från Hexo1 och Hexo2, kopplats till produktion av paucimannosidisk protein av fruktflugor. Men med undantag för de välstuderade D. melanogaster och andra vanliga insektsmodellorganismer, är solida bevis för aktiv involvering av Hex och/eller möjlig samordnad användning av den GnT-I-oberoende vägen eller alternativa trunkeringsvägar för produktion av paucimannosidisk protein fortfarande otillgängliga över den olika klassen av insekter.
Nematoder
Modellorganismen C. elegans är väl studerad; solid glykobiologisk litteratur har gett insikter om det nematodala N -glykosyleringsmaskineriet som delar många egenskaper med andra eukaryota arter. C. elegans är känt för att producera paucimannosidicproteiner via en GnT-I-beroende väg i vilken GnT-I först producerar GlcNAc-kapslade glykoproteinintermediärer. Ytterligare bearbetning av två Hex-isoenzymer (HEX-2 och HEX-3) som kodas av två C. elegans- gener (hex-2, hex-3) genererar de osubstituerade C. elegans paucimannosidic-glykanerna.
Andra glykoenzymer katalyserar vidare bearbetning och strukturell mångfald inklusive α-Man II och α1,6- och α1,3-fukosyltransferaser. Även om det är mindre aktivt har ett GnT-I-oberoende α1,6-fukosyltransferas också observerats för C. elegans , vilket indikerar att både de GnT-I-beroende och -oberoende vägarna kan bidra till bildandet av paucimannosidic N -glykoproteiner i maskar. De biosyntetiska processerna som ligger till grund för de ovanliga icke-socker- och kärnmodifierade paucimannosidic N -glykanerna i C. elegans återstår dock att belysas.
Växter
Hexosaminidaser (Hex) är viktiga glykosidhydrolaser för generering av växtspecifika paucimannosidproteiner över Plantae. HEXO1-HEXO3 har rapporterats vara nyckelmediatorer för uttryck av paucimannos i olika växtarter inklusive Nicotiana benthamiana, A.thaliana och L. japonicus . Dessutom rapporterades α1,3-fukosyltransferas (FUT11/12) och β1,2-xylosyltransferas såväl som α-mannosidas II också spela avgörande roller i genereringen av paucimannosidproteiner som uttrycks av växter.
Ryggradsdjur
Hos människor är den hex-medierade GnT-I-beroende trunkeringsvägen känd för att underlätta, åtminstone i vissa vävnader inklusive neutrofiler, produktionen av paucimannosidproteiner. Humana Hex-isoenzymer är sammansatta med alfa- och beta-subenheter som kodas av HEXA- respektive HEXB-generna. Från dessa två subenheter genereras isoenzymer såsom Hex A (en alfa- och en beta-subenhet), Hex B (två beta-subenheter) och Hex S (två alfa-subenheter). Både Hex A och Hex B har rapporterats spela viktiga funktionella roller hos människor, särskilt i den lysosomala nedbrytningen av gangliosider. Nyligen dokumenterades både HEXA och HEXB för att mediera proteinpaucimannosylering i humana neutrofiler och kan därför också vara den främsta drivkraften för den förhöjda produktionen av paucimannosidicproteiner under cancerutveckling. Nyligen genomförda in vitro-observationer har föreslagit andra icke-kanoniska trunkeringsvägar med direkt kärnfukosylering av paucimannosidproteiner hos ryggradsdjur, men detta återstår att validera Hex A- och Hex B-isoenzymer finns huvudsakligen i de azurofila granulerna hos mänskliga neutrofiler som ett resultat av en föreslagen målinriktning. by-timing-mekanism som förmodas styr dessa enzymer till detta fack under neutrofilutveckling. Nyligen visades granulspecifik glykosylering i neutrofiler med framträdande paucimannosylering i de azurofila granulerna, en observation som föreslogs härröra från en "glykosylering-by-timing"-mekanism som ännu inte har dokumenterats. Mer allmänt över ryggradsdjursarter förblir biosyntesen av paucimannosidicproteiner i stort sett ostuderad.
Funktioner av proteinpaucimannosylering
Mänsklig
Funktionen av proteinpaucimannosylering förblir i stort sett outforskad hos ryggradsdjur. Ny litteratur har emellertid dykt upp som visar att paucimannosylering spelar roller i att förmedla patofysiologiska processer såsom vid inflammation, patogeninfektion, cancer och i utvecklingen av stamceller och i normal homeostas. Till exempel visades förhöjt uttryck av paucimannosidic-proteiner i Mycobacterium tuberculosis-infekterade makrofager, under preclampsia och på Tamm-Horsfall-proteiner som utsöndras av mänskliga urotelceller under urinvägsinfektioner, vilket tyder på involveringen av paucimannosylering under dessa tillstånd. Dessutom observerades sputum från individer som lider av cystisk fibros och luftvägsinfektioner också vara rikt på paucimannosidproteiner. Dessutom rapporterades paucimannosylering vara framträdande egenskaper hos humana neutrofiler och i monocyter och makrofager. Ny litteratur har också visat förhöjda signaturer av paucimannosidproteiner associerade med en rad humana cancerformer inklusive hjärn-, bröst-, blod-, melanom, icke-melanom, lever-, äggstockscancer och prostatacancer. Anrikade paucimannosidic glykoepitoper hittades i tumörerna jämfört med de intilliggande icke-tumörvävnaderna. Litteratur har också rapporterat förekomsten av paucimannosylering i embryonala stamceller och neuronala stamceller, vilket tyder på potentiella funktionella roll(er) i dessa celler. Särskilt resulterar brist på hexosaminidaser i kliniskt signifikanta Tay-Sachs- och Sandhoff -sjukdomar, vilket också implicerar Hex- och paucimannosidicproteiner i dessa tillstånd.
Endogena och exogena bindningspartners för paucimannosidglykaner från däggdjur har föreslagits, inklusive makrofagmannosreceptorn (CD206) och dektin-2. Andra förmodade endogena paucimannosidproteinreceptorer såsom dektin-1, DC-SIGN och DC-SIGNR har föreslagits, men experimentellt stöd saknas fortfarande. Exogena bindemedel av paucimannosidic glykaner såsom Escherichia coli FimH och P. aeruginosa PA-IIL rapporterades också spela viktiga roller i vidhäftningen och patofysiologin för dessa opportunistiska patogener.
Insekter
Hos D. melanogaster visade mutanter med brist på FDL paucimannosbrist och orsakade framför allt rörelsedefekter hos fruktflugor, vilket indikerar att Hex- och/eller paucimannosidproteiner är involverade, via svårfångade vägar, i väsentliga fruktflugaprocesser. Som förväntat visades den mindre följdriktiga monoalleliska fdl-mutationen resultera i minskad paucimannosidisk proteinbildning och orsakade en icke-dödlig, men fortfarande allvarlig fenotyp, genom att stoppa genereringen av perifera långtidsminnesneuroner. Försämrad generering av perifera långtidsminnesneuroner observerades också för fruktfluga fdl och MgatI nollmutationer, vilket i sin tur resulterade i infertilitet och rörelsedefekter. Bristen på fukosylerade paucimannosidic glykaner föreslogs bidra till neuronal försämring i både fdl och Mgat1 mutanter. Vikten av fukosylerade paucimannosidic-glykaner stöddes av en studie som rapporterade att mutationer i FucT6-genen som kodar för D. melanogaster α1,6-fucosyltransferas resulterade i ett försämrat immunsvar av fruktflugor mot parasitiska infektioner. Sammantaget tyder dessa fenotypiska observationer på att fruktflugans paucimannosidic-glykaner, av vilka några överlappar den mänskliga repertoaren, är centrala i utvecklingen, immunfunktionen och överlevnadsprocesserna för D. melanogaster. Det rapporterades att T. castaneum uttrycker rikligt paucimannosidic proteiner under dess post-larvstadier, recapitulering fynd från andra studier som föreslår att paucimannosidic proteiner är starkt reglerade under tidig utveckling. Det är således troligt att paucimannosidic glykaner konjugerade till fortfarande okända mjölbaggebärarproteiner, liknande de i nematoder och fruktflugor, är avgörande för mjölbaggens tillväxt och överlevnadsprocesser.
Nematoder
Uttryck av fosfokolin-modifierade och osubstituerade C. elegans paucimannosidic glycans är enligt uppgift utvecklingsstadiespecifik, vilket innebär viktiga roller i nematodal utveckling. Som stöd visade C. elegans hex-2 gen knock-out mutanter minskade paucimannosidic proteinnivåer och förändrad känslighet mot nematotoxiska lektiner i förhållande till vildtyp maskar, en korrelation som tyder på involvering av paucimannosidic proteiner i viktiga C. elegans överlevnadsprocesser. Funktionellt visades fosfokolin-innehållande paucimannosidic glykaner uppvisa immunmodulerande roller i parasitiska nematoder. Paucimannosidic glykaner föreslogs spela roller i det nematodala medfödda immunsystemet genom att påverka nematodens förmåga att bekämpa och överleva patogena bakterier