Glutaminiskt proteas
| Scytalidopepsin B | |||||||
|---|---|---|---|---|---|---|---|
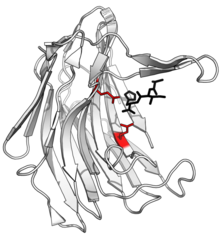 Struktur av scytalidocarboxyl peptidase B , med kluven peptidprodukt i svart och aktiva ställe glutamat-glutamin dyad sidokedjor i rött. ()
| |||||||
| Identifierare | |||||||
| Organism | |||||||
| Symbol | N/A | ||||||
| PDB | 1S2K | ||||||
| UniProt | P15369 | ||||||
| Övriga uppgifter | |||||||
| EG-nummer | 3.4.23.32 | ||||||
| |||||||
Glutaminproteaser är en grupp proteolytiska enzymer som innehåller en glutaminsyrarest inom det aktiva stället. Denna typ av proteas beskrevs första gången 2004 och blev den sjätte katalytiska typen av proteas. Medlemmar av denna grupp av proteaser hade tidigare antagits vara ett aspartatproteas , men strukturell bestämning visade att det tillhörde en ny proteasfamilj. Den första strukturen i denna grupp av proteas var scytalidoglutamiskt peptidas , vars aktiva ställe innehåller en katalytisk dyad, glutaminsyra (E) och glutamin (Q), som ger upphov till namnet eqolisin . Denna grupp av proteaser finns främst i patogena svampar som påverkar växter och människor.
Distribution och typer

Det finns två oberoende familjer av glutaminproteaser (G1 och G2), och har en begränsad distribution. De ansågs ursprungligen vara begränsade till filamentösa svampar främst i Ascomycota phylum. Därefter har emellertid glutaminproteaser identifierats i bakterier och arkéer . Ett glutaminproteas från ett växtvirus ( jordgubbsfläckvirus ) har också identifierats.
Den första superfamiljen av glutaminproteaser identifierades i svamparna Scytalidium lignicola och Aspergillus niger var. macrosporus , från vilket scytalidoglutamiskt peptidas (eqolisin) respektive aspergilloglutamiskt peptidas härleds. Dessa två proteaser innehåller Glu- och Gln-rester på det aktiva stället och är grupperade under MEROPS- familjen G1.
Ett konvergent utvecklat glutaminiskt peptidas, pre-neck appendage-proteinet (bakteriofag phi-29), använder en Glu- och Asp-dyad på det aktiva stället och klassificeras som MEROPS-familjen G2.
Egenskaper
Dessa enzymer är sura proteaser; eqolisin är till exempel mest aktivt vid pH 2,0 när kasein används som substrat. Ekolosiner föredrar skrymmande aminosyrarester vid P1-stället och små aminosyrarester vid P1'-stället. Ett kännetecken för proteaset är dess okänslighet mot pepstatin och S-PI (acetylpepstatin) och det klassades tidigare som "pepstatin-okänsliga karboxylproteinaser". De andra "pepstatin-okänsliga karboxylproteinaserna" tillhör underfamiljen av serinproteas , serin-karboxylproteas (sedolisin) som upptäcktes 2001. Dessa proteaser hämmas inte heller av DAN (diazoacetyl-DL-norleucinmetylester) (7) men kan hämmas av EPNP (1,2-epoxi-3-( p- nitrofenoxi)propan).
Aktivt ställe och mekanism för katalys
Det aktiva stället för eqolosin innehåller en distinkt glutaminsyra- och glutaminkatalytisk dyad som är involverad i substratbindning och katalys. Dessa rester fungerar som en nukleofil, där glutaminsyran fungerar som en allmän syra i den första fasen av reaktionen och donerar en proton till karbonylsyren i substratets peptidbindning. En eller två vattenmolekyler kan vara involverade i reaktionen som tillhandahåller en hydroxylgrupp, och glutaminsyran donerar ytterligare en proton till amidkvävet, vilket resulterar i att peptidbindningen bryts. Glutaminen återställer sedan glutaminsyran till dess ursprungliga tillstånd.