Gasvesikel
Gasvesiklar , även kända som gasvakuoler , är nanokompartment i vissa prokaryota organismer, som hjälper till med flytkraft. Gasvesiklar består helt av protein ; inga lipider eller kolhydrater har upptäckts.
Fungera
Gasvesiklar förekommer främst i vattenlevande organismer eftersom de används för att modulera cellens flytkraft och modifiera cellens position i vattenpelaren så att den kan placeras optimalt för fotosyntes eller flytta till platser med mer eller mindre syre. Organismer som kan flyta till luft-vätska-gränssnittet ut konkurrerar andra aerober som inte kan stiga upp i en vattenpelare genom att använda upp syre i det översta lagret.
Dessutom kan gasvesiklar användas för att upprätthålla optimal salthalt genom att placera organismen på specifika platser i en skiktad vattenmassa för att förhindra osmotisk chock . Höga koncentrationer av löst ämne gör att vatten dras ut ur cellen genom osmos , vilket orsakar cellys. Förmågan att syntetisera gasvesiklar är en av många strategier som tillåter halofila organismer att tolerera miljöer med hög salthalt.
Evolution
Gasvesiklar är sannolikt en av de mest tidiga rörlighetsmekanismerna bland mikroskopiska organismer på grund av det faktum att det är den mest utbredda formen av motilitet som bevaras inom genomet hos prokaryoter, av vilka några har utvecklats för cirka 3 miljarder år sedan. Aktiv motilitetssätt som flagellarörelser kräver en mekanism som kan omvandla kemisk energi till mekanisk energi, och är därför mycket mer komplex och skulle ha utvecklats senare. Gasvesiklarnas funktioner är också till stor del bevarade bland arter, även om regleringssättet kan skilja sig åt, vilket tyder på vikten av gasvesiklar som en form av motilitet. I vissa organismer såsom enterobacterium Serratia sp. flagella-baserad motilitet och gasvesikelproduktion regleras motsatt av ett enda RNA-bindande protein, RsmA, vilket föreslår alternativa sätt för miljöanpassning som skulle ha utvecklats till olika taxoner genom reglering av utvecklingen mellan motilitet och flotation.
Även om det finns bevis som tyder på den tidiga utvecklingen av gasvesiklar, fungerar plasmidöverföring som en alternativ förklaring av organellens utbredda och konserverade natur. Klyvning av en plasmid i Halobacterium halobium resulterade i förlust av förmågan att biosyntetisera gasvesiklar, vilket indikerar möjligheten för horisontell genöverföring, vilket kan resultera i en överföring av förmågan att producera gasvesiklar mellan olika bakteriestammar.
Strukturera
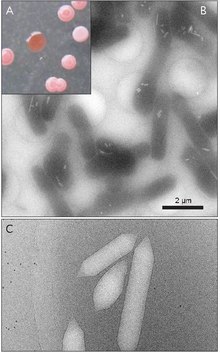
Gasvesiklar är vanligtvis citronformade eller cylindriska, ihåliga rör av protein med koniska lock i båda ändar. Vesiklerna varierar mest i diameter. Större vesiklar kan hålla mer luft och använda mindre protein vilket gör dem mest ekonomiska när det gäller resursanvändning, men ju större en vesikel är desto strukturellt svagare är den under tryck och desto mindre tryck krävs innan vesikeln skulle kollapsa. Organismer har utvecklats till att vara de mest effektiva med proteinanvändning och använder den största maximala vesikeldiametern som kommer att motstå det tryck som organismen kan utsättas för. För att naturligt urval ska ha påverkat gasvesiklar måste vesiklarnas diameter styras av genetik. Även om gener som kodar för gasvesiklar finns i många arter av haloarchaea , producerar endast ett fåtal arter dem. Den första Haloarchaeal gasvesikelgenen, GvpA, klonades från Halobacterium sp. NRC-1. 14 gener är involverade i bildandet av gasvesiklar i haloarchaea.
Den första gasvesikelgenen, GvpA, identifierades i Calothrix. Det finns minst två proteiner som utgör en cyanobakteries gasvesikel: GvpA och GvpC. GvpA bildar revben och mycket av massan (upp till 90%) av huvudstrukturen. GvpA är starkt hydrofobt och kan vara ett av de mest kända hydrofoba proteinerna. GvpC är hydrofilt och hjälper till att stabilisera strukturen genom periodiska inneslutningar i GvpA-revbenen. GvpC kan tvättas ut ur vesikeln och en följdminskning av vesikelns styrka. Tjockleken på vesikelns vägg kan variera från 1,8 till 2,8 nm. Den räfflade strukturen av vesikeln är tydlig på både inre och yttre ytor med ett avstånd på 4–5 nm mellan revbenen. Vesiklar kan vara 100–1400 nm långa och 45–120 nm i diameter.
Inom en art är gasvesikelstorlekarna relativt enhetliga med en standardavvikelse på ±4 %.
Tillväxt
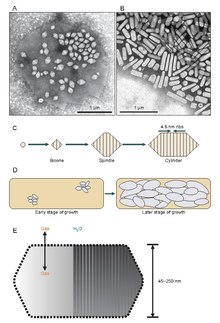
Det verkar som om gasvesiklar börjar existera som små bikoniska (två koner med de platta baserna sammanfogade) strukturer som förstoras till den specifika diametern än att växa och utöka sin längd. Det är okänt exakt vad som styr diametern men det kan vara en molekyl som stör GvpA eller så kan formen på GvpA ändras.
förordning
Bildandet av gasvesiklar regleras av två Gvp-proteiner: GvpD, som undertrycker uttrycket av GvpA- och GvpC-proteiner, och GvpE, som inducerar uttryck. Extracellulära miljöfaktorer påverkar också vesikelbildningen, antingen genom att reglera Gvp-proteinproduktionen eller genom att direkt störa vesikelstrukturen.
Ljusintensitet
Ljusintensitet har visat sig påverka produktionen och underhållet av gasvesiklar olika mellan olika bakterier och arkéer. För Anabaena flos-aquae leder högre ljusintensiteter till vesikelkollaps från en ökning av turgortrycket och större ackumulering av fotosyntetiska produkter. Hos cyanobakterier minskar vesikelproduktionen vid hög ljusintensitet på grund av att bakterieytan exponeras för UV-strålning, vilket kan skada bakteriegenomet.
Kolhydrater
Ackumulering av glukos, maltos eller sackaros i Haloferax mediterranei och Haloferax volcanii visade sig hämma uttrycket av GvpA-proteiner och därför en minskning av gasvesikelproduktionen. Detta inträffade dock endast vid cellens tidiga exponentiella tillväxtfas. Vesikelbildning kan också induceras i minskande extracellulära glukoskoncentrationer.
Syre
Brist på syre visade sig negativt påverka gasvesikelbildningen i halofila arkéer. Halobacterium salinarum producerar få eller inga vesiklar under anaeroba förhållanden på grund av minskad syntes av mRNA-transkript som kodar för Gvp-proteiner. H. mediterranei och H. volcanii producerar inga vesiklar under anoxiska förhållanden på grund av en minskning av syntetiserade transkript som kodar för GvpA och trunkerade transkript som uttrycker GvpD.
pH
Ökade extracellulära pH-nivåer har visat sig öka vesikelbildningen hos Microcytis-arter. Under ökat pH ökar nivåerna av gvpA- och gvpC -transkript, vilket tillåter mer exponering för ribosomer för uttryck och leder till uppreglering av Gvp-proteiner. Det kan tillskrivas större transkription av dessa gener, minskat sönderfall av de syntetiserade transkripten eller den högre stabiliteten hos mRNA.
Ultraljudsstrålning
Ultraljudsstrålning vid vissa frekvenser visade sig kollapsa gasvesiklar i cyanobakterier Spirulina platensis , vilket hindrade dem från att blomma.
Kvorumsavkänning
I enterobacterium; Serratia sp. stam ATCC39006 produceras gasvesikel endast när det finns tillräcklig koncentration av en signalmolekyl, N-acylhomoserinlakton. I detta fall fungerar den kvorumavkännande molekylen, N-acylhomoserinlakton som en morfogen som initierar organellutveckling. Detta är fördelaktigt för organismen eftersom resurser för gasvesikelproduktion endast utnyttjas när det finns en syrebegränsning orsakad av en ökning av bakteriepopulationen.
Roll i vaccinutveckling
Gasvesikelgenen gvp C från Halobacterium sp. används som leveranssystem för vaccinstudier.
Flera egenskaper hos proteinet som kodas av gasvesikelgenen gvp C gör att det kan användas som bärare och adjuvans för antigener: det är stabilt, resistent mot biologisk nedbrytning, tolererar relativt höga temperaturer (upp till 50 °C) och icke-patogent. till människor. Flera antigener från olika mänskliga patogener har rekombinerats till gvp C-genen för att skapa subenhetsvacciner med långvariga immunologiska svar.
Olika genomiska segment som kodar för flera Chlamydia trachomatis -patogens proteiner, inklusive MOMP, OmcB och PompD, är förenade med gvp C-genen från Halobacteria . In vitro -bedömningar av celler visar uttryck av Chlamydia-gener på cellytor genom avbildningstekniker och visar karakteristiska immunologiska svar såsom TLR-aktiviteter och pro-inflammatorisk cytokinproduktion. Gasvesikelgenen kan utnyttjas som en leveransvehikel för att generera ett potentiellt vaccin mot klamydia. Begränsningar av denna metod inkluderar behovet av att minimera skadan av själva GvpC-proteinet samtidigt som så mycket av vaccinmålgenen inkluderas i gvp C-gensegmentet.
Ett liknande experiment använder samma gasvesikelgen och Salmonella enterica- patogenens utsöndrade inosinfosfateffektorprotein SopB4 och SopB5 för att generera en potentiell vaccinvektor. Immuniserade möss utsöndrar pro-inflammatoriska cytokiner IFN-y, IL-2 och IL-9. Antikropp IgG detekteras också. Efter en infektionsutmaning hittades ingen eller signifikant mindre mängd bakterier i de skördade organen såsom mjälten och levern. Potentiella vacciner som använder gasvesikel som antigendisplay kan ges via slemhinnan som en alternativ administreringsväg, vilket ökar dess tillgänglighet för fler människor och framkallar ett bredare spektrum av immunsvar i kroppen.
Roll som kontrastmedel och reportergener
Gasvesiklar har flera fysiska egenskaper som gör dem synliga på olika medicinska avbildningsmodaliteter . Gasvesiklars förmåga att sprida ljus har använts i årtionden för att uppskatta deras koncentration och mäta deras kollapstryck. Den optiska kontrasten hos gasvesiklar gör det också möjligt för dem att fungera som kontrastmedel vid optisk koherenstomografi, med tillämpningar inom oftalmologi . Skillnaden i akustisk impedans mellan gasen i deras kärnor och den omgivande vätskan ger gasvesiklar robust akustisk kontrast. Dessutom genererar förmågan hos vissa gasvesikelskal att buckla harmoniska ultraljudsekon som förbättrar förhållandet kontrast till vävnad. Slutligen kan gasvesiklar användas som kontrastmedel för magnetisk resonanstomografi (MRT), beroende på skillnaden mellan den magnetiska känsligheten hos luft och vatten. Förmågan att icke-invasivt kollapsa gasvesiklar med hjälp av tryckvågor ger en mekanism för att radera deras signal och förbättra deras kontrast. Att subtrahera bilderna före och efter akustisk kollaps kan eliminera bakgrundssignaler vilket förbättrar upptäckten av gasvesiklar.
Heterologt uttryck av gasvesiklar i bakterie- och däggdjursceller möjliggjorde deras användning som den första familjen av akustiska reportergener . Medan fluorescerande reportergener som grönt fluorescerande protein (GFP) hade utbredd användning inom biologi, begränsas deras in vivo- applikationer av ljusets penetrationsdjup i vävnad, vanligtvis några mm. Luminescens kan detekteras djupare i vävnaden, men har en låg rumslig upplösning. Akustiska reportergener ger rumslig upplösning under millimeter och ett penetrationsdjup på flera centimeter, vilket möjliggör in vivo- studier av biologiska processer djupt inne i vävnaden.

