Galen 1
| Mad1 | |||||||
|---|---|---|---|---|---|---|---|
 Kristallstruktur, tetramer av Mad1-Mad2 komplex, gul och röd=Mad1 monomerer, blekgrön= Mad2 monomerer
| |||||||
| Identifierare | |||||||
| Organism | |||||||
| Symbol | MAD1 | ||||||
| Entrez | 852794 | ||||||
| PDB | 1GO4 | ||||||
| RefSeq (mRNA) | NM_001180951.3 | ||||||
| RefSeq (Prot) | NP_011429.3 | ||||||
| UniProt | P40957 | ||||||
| Övriga uppgifter | |||||||
| Kromosom | VII: 0,35 - 0,35 Mb | ||||||
| |||||||
Mad1 är ett icke-essentiellt protein som i jäst har en funktion i spindle assembly checkpoint (SAC). Denna kontrollpunkt övervakar kromosomfästning till spindelmikrotubuli och förhindrar celler från att starta anafas tills spindeln har byggts upp. Namnet Mad hänvisar till observationen att mutanta celler är bristfälliga i mitotiska arresteringar (MAD) under mikrotubulusdepolymerisation. Mad1 rekryterar anafashämmaren Mad2 till obundna kinetokorer och är väsentlig för Mad2- Cdc20- komplexbildning in vivo men inte in vitro . In vivo fungerar Mad1 som en kompetitiv hämmare av Mad2-Cdc20-komplexet. Mad1 fosforyleras av Mps1 vilket sedan tillsammans med andra aktiviteter leder till bildandet av det mitotiska kontrollpunktskomplexet (MCC). Därigenom hämmar det aktiviteten hos det anafasfrämjande komplexet/cyklosomen (APC/C). Homologer av Mad1 bevaras i eukaryoter från jäst till däggdjur.
Introduktion
I början av 90-talet identifierades jästgener vilka mutationer resulterade i en defekt i mitotiskt arrest som svar på demontering av mikrotubuli (gener med brist på mitotiskt arrest - MAD-gener). Dessa celler visade inget mitotiskt stopp i närvaro av mikrotubuluspolymerisationshämmare och kunde därför inte fördröja celldelning. De gener som identifierades inkluderade generna MAD1 , MAD2 och MAD3 . De är bevarade i alla eukaryoter och är involverade i en väg som är aktiv i prometafas för att förhindra för tidig separation av systerkromatider och utgör den så kallade spindle assembly checkpoint (SAC). Denna kontrollpunkt övervakar statusen för kromosomfästningen till den mitotiska spindeln och hämmar metafas till anafas genom att förhindra aktivering av det anafasfrämjande komplexet /cyklosomen (APC/C) och därmed nedbrytningen av cellcykelregulatorer . Mad1 ackumuleras i denna väg vid obundna kinetokorer och fungerar som en sensor för obundna kinetokorer i detta maskineri.
Fungera
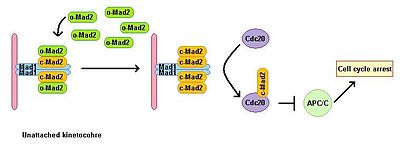
Eukaryota celler visar ett mitotiskt stopp i närvaro av mikrotubulipolymerisationshämmare. En kontrollpunkt för spindelsammansättning övervakar spindelns status och länkar metafas-anafasövergången till korrekt bipolär anslutning av alla kinetokorer till den mitotiska spindeln. Kontrollpunkten för spindelsammansättningen hämmar aktiviteten hos det anafasfrämjande komplexet genom att förhindra nedbrytning av effektorer nedströms, som annars leder till anafasstart och utträde ur mitos. Utarmning av Mad1 leder till förlust av SAC- funktion. Mad1 lokaliseras övervägande vid obundna kinetokorer och utlöser mitotiskt stopp i händelse av en enstaka obunden kinetokor. Mad1 rekryterar den viktiga SAC-komponenten Mad2 till obundna kinetokorer och inducerar förstärkning av mitotiska arresteringssignaler. Det finns en pool av fri cytoplasmatisk Mad2 i dess inaktiva öppna konformation som kallas o-MAD2. När bunden till Mad1 antar Mad2 en aktiv konformation som kallas sluten (c-Mad2) och bildar en heterotetramer av två Mad1- och två c-Mad2-enheter. Heterotetrameren av Mad1–c-Mad2 är mycket stabil och fungerar som en katalytisk receptor för fri cytoplasmatisk o-Mad2. Free o-Mad2 binder till denna receptor och ändrar dess konformation till den aktiva slutna formen. Denna andra c-MAD2 överförs till Cdc20 med ännu okänd mekanism och bildar Cdc20–c-Mad2-komplex. Detta komplex är en viktig komponent i mitotiska kontrollpunktskomplex (MCC). MCC binder och hämmar APC /C och stoppar därför progression genom mitos.
förordning
Det finns två uppströms checkpoint- kinaser som är inblandade i att reglera Mad1-funktionen genom fosforylering . Mps1 fosforylerar Mad1 både in vitro och in vivo och tros reglera Mad1 och Mad2 lokalisering till kinetokorer och deras interaktionsdynamik. BUB1 är det andra kinaset som rekryterar Mad1 till kinetokorer och aktiverar det om en kinetokor är obunden. Om en kinetokor är fäst vid spindeln, hämmar SAC-hämmaren p31 komet Mad1-medierad konformationell omarrangering av Mad2 och förhindrar Mad2 från att binda till Cdc20.
Strukturella egenskaper och mekanism
Genom biokemiska metoder förutspåddes Mad1 koda för ett 90kD, 718-rester, coiled-coil- protein med en karakteristisk stavform 1995. Kristallstrukturer följde snart. Sedan publicerades 2002 kristallstrukturen för mänsklig Mad1 i komplex med mänsklig Mad2 som bildar en tetramer. På grund av experimentella begränsningar visar strukturen endast Mad1-rester 484 - 584. Långsträckta Mad1-monomerer hålls tätt samman av en parallell lindad spole som involverar de N-terminala alfaspiralerna. Mad1-kedjorna pekar bort från coiled-coilen mot deras Mad2-ligander och bildar två subkomplex med Mad2. Segmentet mellan alfahelix 1 och 2 innehåller Mad2-bindningsdomänen. Den första delen av denna bindande domän är flexibel och antar olika konformationer som ger upphov till ett asymmetriskt komplex. I sitt arbete, med hjälp av termodynamiska studier, har Sironi et al. visar att Mad1 fungerar som att bromsa hastigheten för Mad2- Cdc20- komplexbildning och därför fungerar som en kompetitiv hämmare in vivo . Dessutom föreslår författarna att Mad1-Mad2-bindningsställena är begravda inuti strukturen, vilket kanske gör bindningsställena otillgängliga för Cdc20-bindning. Mad1-Mad2-bindning är ovanlig eftersom Mad2 C-terminalen viks över Mad1. Författarna drar därför slutsatsen att ett ostört Mad1-Mad2-komplex inte kommer att släppa Mad2 som kräver en ny, hittills dåligt förstådd, mekanism för konformationsförändring.
Cancer
Felmatchningar i kromosomantal (aneuploidier) under meios är ansvariga för mänskliga sjukdomar som Downs syndrom och dyker också upp ofta i cancerceller. Den väsentliga funktionen hos SAC ger upphov till hypotesen att mutationer av SAC och särskilt inaktivering av SAC kan vara en orsak till tumörbildning eller åtminstone underlätta tumörbildning. Mot denna idé visades det att cancerceller genomgår apoptos när komponenter i SAC inte är närvarande. I denna modell, i motsats till den andra modellen, blir SAC-inaktivering ett potentiellt sätt att döda snabbt delande cancerceller. De molekylära kopplingarna mellan Mad1p, SAC, apoptos och cancer är fortfarande inte helt klarlagda.
