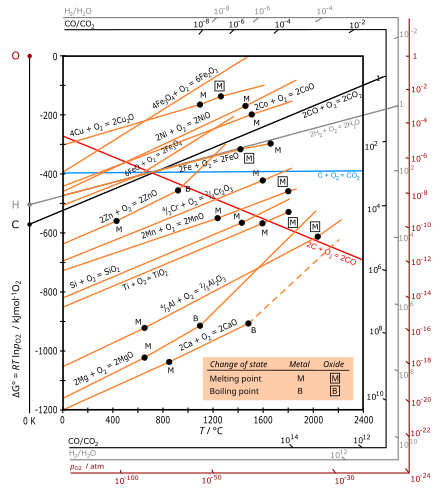
Ellingham diagram
Ett Ellingham-diagram är en graf som visar temperaturberoendet av föreningars stabilitet. Denna analys används vanligtvis för att utvärdera hur lätt det är att reducera metalloxider och sulfider . Dessa diagram konstruerades först av Harold Ellingham 1944. Inom metallurgi används Ellingham-diagrammet för att förutsäga de bildade produkterna och Gibbs energitillämpning mellan en metall , dess oxid och syre - och i förlängningen, reaktioner av metall med svavel , kväve , och andra icke-metaller . Diagrammen är användbara för att förutsäga de förhållanden under vilka en malm kommer att reduceras till sin metall. Analysen är termodynamisk till sin natur och ignorerar reaktionskinetik . Således kan processer som förutspås vara gynnsamma av Ellingham-diagrammet fortfarande vara långsamma.
Termodynamik
Ellingham-diagram är en speciell grafisk form av principen att den termodynamiska genomförbarheten av en reaktion beror på tecknet för Δ G , Gibbs fria energiförändring , som är lika med Δ H − T Δ S , där Δ H är entalpiförändringen och Δ S är entropiförändringen .
Ellingham-diagrammet plottar Gibbs fria energiförändring (Δ G ) för varje oxidationsreaktion som en funktion av temperaturen. För jämförelse av olika reaktioner hänvisar alla värden för Δ G till reaktionen av samma kvantitet syre, vald som en mol O ( 1 ⁄ 2 mol O
2 ) av vissa författare och en mol O
2 av andra. Diagrammet som visas avser 1 mol O
2 , så att t.ex. linjen för oxidationen av krom visar Δ G för reaktionen 4 ⁄ 3 Cr(s) + O
2 (g) → 2 ⁄ 3 Cr
2 O
3 (s) , vilket är 2 ⁄ 3 av molar Gibbs bildningsenergi Δ G f °( Cr
2 O
3 , s).
I de temperaturområden som vanligtvis används är metallen och oxiden i ett kondenserat tillstånd (fast eller flytande), och syre är en gas med mycket större molär entropi. För oxidationen av varje metall är det dominerande bidraget till entropiförändringen (Δ S ) avlägsnandet av 1 ⁄ 2 mol O
2 , så att ΔS är negativt och ungefär lika för alla metaller. Lutningen på plotten är därför positiv för alla metaller, där Δ G alltid blir mer negativ med lägre temperatur, och linjer för alla metalloxider är ungefär parallella. Eftersom dessa reaktioner är exoterma blir de alltid möjliga vid lägre temperaturer. Vid en tillräckligt hög temperatur kan tecknet på Δ G inverteras (bli positivt) och oxiden kan spontant reduceras till metallen, som visas [ var? ] för Ag och Cu.
För oxidation av kol är den röda linjen för bildning av CO: C(s) + 1 ⁄ 2 O
2 (g) → CO(g) med en ökning av antalet mol gas, vilket leder till en positiv Δ S och en negativ lutning. Den blå linjen för bildning av CO 2 är ungefär horisontell, eftersom reaktionen C(s) + O
2 (g) → CO 2 (g) lämnar antalet mol gas oförändrat så att Δ S är litet.
Som med alla kemiska reaktionsförutsägelser baserade på rent termodynamiska grunder, kan en spontan reaktion vara mycket långsam om ett eller flera steg i reaktionsvägen har mycket höga aktiveringsenergier E A .
Om två metaller är närvarande måste två jämvikter beaktas. Oxiden med den mer negativa Δ G kommer att bildas och den andra oxiden kommer att reduceras.
Diagramfunktioner
- Kurvor i Ellingham-diagrammen för bildning av metalloxider är i princip raka linjer med positiv lutning. Lutningen är proportionell mot Δ S , som är praktiskt taget konstant med temperaturen.
- Ju lägre position en metalls linje har i Ellingham-diagrammet, desto större är stabiliteten för dess oxid. Till exempel har linjen för Al (oxidation av aluminium ) visat sig vara under den för Fe (bildning av Fe
2 O
3 ). - Metalloxidernas stabilitet minskar med ökad temperatur. Mycket instabila oxider som Ag
2 O och HgO genomgår lätt termisk nedbrytning. - Den fria energin för koldioxid (CO 2 ) är nästan oberoende av temperatur, medan den för kolmonoxid (CO) har negativ lutning och korsar CO 2 -linjen nära 700 °C. Enligt Boudouard-reaktionen är kolmonoxid den dominerande oxiden av kol vid högre temperaturer (över cirka 700 °C), och ju högre temperatur (över 700 °C) desto effektivare är ett reduktionsmedel (reduktionsmedel) kol.
- Om kurvorna för två metaller vid en given temperatur jämförs, kommer metallen med den lägre Gibbs fria oxidationsenergin på diagrammet att minska oxiden med den högre Gibbs fria bildningsenergin. Till exempel kan metalliskt aluminium reducera järnoxid till metalliskt järn, varvid själva aluminiumet oxideras till aluminiumoxid. (Denna reaktion används i termit .)
- Ju större gapet mellan två linjer, desto större är effektiviteten hos reduktionsmedlet som motsvarar den undre linjen.
- Skärningen av två linjer innebär en oxidation-reduktionsjämvikt. Reduktion med användning av ett givet reduktionsmedel är möjligt vid temperaturer över skärningspunkten där Δ G -linjen för det reduktionsmedlet är lägre i diagrammet än för den metalloxid som ska reduceras. Vid skärningspunkten är förändringen av den fria energin för reaktionen noll, under denna temperatur är den positiv och metalloxiden är stabil i närvaro av reduktionsmedlet, medan över skärningspunkten är Gibbs-energin negativ och oxiden kan vara nedsatt.
Reduktionsmedel
I industriella processer sker reduktionen av metalloxider ofta genom en karbotermisk reaktion , med kol som reduktionsmedel. Kol finns billigt som kol , som kan omvandlas till koks . När kol reagerar med syre bildar det de gasformiga oxiderna kolmonoxid och koldioxid , så termodynamiken för dess oxidation skiljer sig från den för metaller: dess oxidation har en mer negativ Δ G med de högre temperaturerna (över 700 °C). Kol kan alltså fungera som reduktionsmedel . Med användning av denna egenskap kan reduktion av metaller utföras som en dubbel redoxreaktion vid relativt låg temperatur.
Användning av Ellingham-diagram
Den huvudsakliga tillämpningen av Ellingham-diagram är inom den extraktiva metallurgiska industrin, där det hjälper till att välja det bästa reduktionsmedlet för olika malmer i extraktionsprocessen, reningen och graderingen för ståltillverkning. Det hjälper också till att styra reningen av metaller, särskilt avlägsnandet av spårämnen. Den direkta reduktionsprocessen för att tillverka järn vilar starkt på ledning av Ellingham-diagram, som visar att väte i sig kan reducera järnoxider till metallen.
Reduktionsmedel för hematit
Vid smältning av järnmalms reduceras hematit i toppen av ugnen , där temperaturen ligger i intervallet 600 – 700 °C. Ellingham-diagrammet indikerar att i detta intervall verkar kolmonoxid som ett starkare reduktionsmedel än kol sedan processen
- 2 CO + O
2 → 2 CO 2
har en mer negativ fri energiförändring än processen:
- 2C +
O2 → 2CO.
I den övre delen av masugnen reduceras hematit av CO (framställt genom oxidation av koks lägre ner i botten av masugnen, vid högre temperatur) även i närvaro av kol – även om detta främst beror på kinetiken för gasformig CO reagerar med malmen är bättre.
Reduktionsmedel för kromoxid-kol kan inte användas
Ellingham-kurvan för reaktionen 2C(s) + O
2 (g) → 2CO(g) sluttar nedåt och faller under kurvorna för alla metaller. Därför kan kol normalt fungera som ett reduktionsmedel för alla metalloxider vid mycket höga temperaturer. Men krom som bildas vid dessa temperaturer reagerar med kol och bildar dess karbid, vilket ger oönskade egenskaper åt den erhållna krommetallen. Därför kan kol inte användas för att reducera kromoxid vid hög temperatur.
Termisk aluminiumprocess
Ellingham-kurvan för aluminium ligger under kurvorna för de flesta metaller som krom , järn , etc. Detta faktum indikerar att aluminium kan användas som reduktionsmedel för oxider av alla dessa metaller. Detta resultat illustreras enligt följande:
De fria energierna för bildning av krom(III)oxid och aluminiumoxid per mol förbrukat syre är -541 kJ respektive -827 kJ. Processerna är:
-
()
-
()
Den andra ekvationen minus den första ekvationen ger:
-
()
Så aluminiumoxid är stabilare än kromoxid (åtminstone vid normala temperaturer, och faktiskt ända upp till oxidernas nedbrytningstemperaturer). Eftersom Gibbs fria energiförändring är negativ, kan aluminium reducera kromoxid.
Inom pyrometallurgi används aluminium som ett reduktionsmedel i den aluminiumtermiska processen eller termitprocessen för att extrahera krom och mangan genom reduktion av deras oxider.
Utvidgning till andra gasfasreaktioner
Konceptet att plotta de fria reaktionsenergierna för olika element med en given gasfasreaktant kan utsträckas bortom oxidationsreaktioner. Den ursprungliga uppsatsen av Ellingham uttryckligen för att reducera både syre och svavel genom metallurgiska processer, och förutsåg användningen av sådana diagram för andra föreningar, inklusive klorider, karbider och sulfater. Konceptet är generellt användbart för att studera den jämförande stabiliteten hos föreningar över ett intervall av partialtryck och temperaturer. Konstruktionen av ett Ellingham-diagram är särskilt användbart när man studerar stabiliteten hos föreningar i närvaro av ett reduktionsmedel. Ellingham-diagram finns nu för bromider, klorider, fluorider, hydrider, jodider, nitrider, oxider, sulfider, selenider och tellurider.
externa länkar
- Interaktiva Ellingham-diagram Arkiverade 2007-10-24 på Wayback Machine vid San José State University
- Ellingham diagram handledning och interaktivt diagram ( University of Cambridge )