Cellcykelanalys
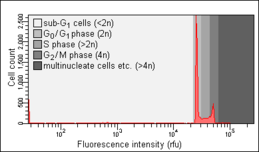
0 Cellcykelanalys genom DNA-haltsmätning är en metod som oftast använder flödescytometri för att särskilja celler i olika faser av cellcykeln . Före analys permeabiliseras cellerna vanligtvis och behandlas med ett fluorescerande färgämne som färgar DNA kvantitativt, såsom propidiumjodid (PI) eller 4,6-diamidino-2-phenylindole (DAPI). Fluorescensintensiteten hos de färgade cellerna korrelerar med mängden DNA de innehåller. Eftersom DNA-innehållet fördubblas under S-fasen , kommer DNA-innehållet (och därmed intensiteten av fluorescens) i celler i 0 G- fasen och G 1 -fasen (före S), i S-fasen och i G 2 - fasen och M-fasen ( efter S) identifierar cellcykelfaspositionen i huvudfaserna (G /Gi mot S mot G2 / M-fasen) av cellcykeln. Det cellulära DNA-innehållet i individuella celler plottas ofta som deras frekvenshistogram för att ge information om relativ frekvens (procent) av celler i de viktigaste faserna av cellcykeln.
0 Cellcykelanomalier som avslöjas på DNA-innehållsfrekvenshistogrammet observeras ofta efter olika typer av cellskador, till exempel sådan DNA-skada som avbryter cellcykelprogressionen vid vissa kontrollpunkter . Ett sådant stopp av cellcykelprogressionen kan leda antingen till en effektiv DNA-reparation, som kan förhindra omvandling av normal till en cancercell ( karcinogenes ), eller till celldöd, ofta genom apoptos . Ett stopp av celler i G eller G 1 ses ofta som ett resultat av brist på näringsämnen (tillväxtfaktorer), till exempel efter serumbrist . Cellcykelanalys beskrevs första gången 1969 vid Los Alamos Scientific Laboratory av en grupp från University of California med användning av Feulgen-färgningstekniken . Det första protokollet för cellcykelanalys med propidiumjodidfärgning presenterades 1975 av Awtar Krishan från Harvard Medical School och är fortfarande flitigt citerat idag.
0 Multiparameteranalys av cellcykeln inkluderar, förutom mätning av cellulärt DNA-innehåll, andra cellcykelrelaterade beståndsdelar/egenskaper. Den samtidiga mätningen av cellulärt DNA- och RNA-innehåll, eller DNA-känslighet för denaturering vid lågt pH med hjälp av det metakromatiska färgämnet akridin orange , avslöjar cellcykelfacken G 1Q , G 1A och G 1B och gör det också möjligt att skilja mellan S, G 2 och mitotiska celler. Cellerna i G 1Q är vilande, tillfälligt utdragna från cellcykeln (även identifierbara som G ), G 1A är i tillväxtfasen medan G 1B är cellerna precis innan de går in i S, med deras tillväxt (RNA- och proteininnehåll, storlek ) liknande den hos cellerna som initierar DNA-replikation. Liknande cellcykelavdelningar känns också igen genom multiparameteranalys som inkluderar mätning av uttryck av cyklin D1 , cyklin E , cyklin A och cyklin B1 , var och en i relation till DNA-innehåll Samtidig mätning av DNA-innehåll och av inkorporering av DNA-prekursor 5-bromo-2 '-deoxiuridin (BrdU) genom flödescytometri är en särskilt användbar analys, som har använts i stor utsträckning vid analys av cellcykeln in vitro och in vivo. Emellertid har införlivandet av 5-etynyl-2'-deoxiuridin (EdU), prekursorn vars detektion erbjuder vissa fördelar jämfört med BrdU, nu blivit den föredragna metoden för att detektera DNA-replikerande (S-fas) celler.
experimentell procedur
Om inte färgning utförs med Hoechst 33342 , är det första steget i att förbereda celler för cellcykelanalys permeabilisering av cellernas plasmamembran . Detta görs vanligtvis genom att inkubera dem i en buffertlösning som innehåller ett milt rengöringsmedel som Triton X-100 eller NP-40 , eller genom att fixera dem i etanol . De flesta fluorescerande DNA-färgämnen (ett av undantagen är Hoechst 33342 ) är inte plasmamembrangenomsläppliga, det vill säga inte kan passera genom ett intakt cellmembran. Permeabilisering är därför avgörande för att nästa steg, färgningen av cellerna, ska lyckas.
Före (eller under färgningssteget) behandlas cellerna ofta med RNas A för att avlägsna RNA . Detta är viktigt eftersom vissa färgämnen som färgar DNA också kommer att färga RNA, vilket skapar artefakter som skulle förvränga resultaten. Ett undantag är den metakromatiska fluorokromakridinorange , som enligt det specifika färgningsprotokollet differentiellt kan färga både RNA (genererar röd luminescens) och DNA (grön fluorescens), eller i ett annat protokoll, efter avlägsnande av RNA och partiell DNA-denaturering, för att differentiellt färga dubbelsträngat DNA (grön fluorescens) kontra enkelsträngat DNA (röd luminescens) [3] . Bortsett från propidiumjodid och akridinorange inkluderar kvantifierbara färgämnen som ofta används (men är inte begränsade till) DRAQ5, 7-Aminoactinomycin D , DAPI och Hoechst 33342 .
Dubbeldiskriminering
00 Eftersom celler och särskilt fasta celler tenderar att hålla ihop, måste cellaggregat uteslutas från analys genom en process som kallas dubblettdiskriminering . Detta är viktigt eftersom en dubblett av två G /Gi- celler har samma totala innehåll av DNA och därmed samma fluorescensintensitet som en enda G2 / M-cell. Om de inte känns igen som sådana skulle G /Gi - dubletterna bidra till falsk positiv identifiering och räkning av G2 / M-celler.
Relaterade metoder
Nicoletti analys
00000 Nicoletti -analysen , uppkallad efter dess uppfinnare, den italienske läkaren Ildo Nicoletti, är en modifierad form av cellcykelanalys. Det används för att detektera och kvantifiera apoptos , en form av programmerad celldöd , genom att analysera celler med ett DNA-innehåll mindre än 2n ("sub-G /G 1- celler"). Sådana celler är vanligtvis resultatet av apoptotisk DNA-fragmentering : under apoptos bryts DNA ned av cellulära endonukleaser . Därför kärnor av apoptotiska celler mindre DNA än kärnor av friska G /Gi - celler, vilket resulterar i en sub-G /Gi - topp i fluorescenshistogrammet som kan användas för att bestämma den relativa mängden apoptotiska celler i ett prov. Denna metod utvecklades och beskrevs först 1991 av Nicoletti och medarbetare vid Perugia University School of Medicine. Ett optimerat protokoll utvecklat av två av författarna till den ursprungliga publikationen publicerades 2006. Objekten uppmätta inom sub-G /G 1 -toppen, med DNA-innehåll mindre än 5 % av det för GG 1 - toppen, med all sannolikhet är apoptotiska kroppar och representerar således inte individuella apoptotiska celler
Vidare läsning
- "Cell Cycle Basics" (PDF) . University College London. Arkiverad från originalet (PDF, 0,1 MB) 2011-06-06 . Hämtad 2010-05-20 .
- Rabinovitch, Peter. "Introduktion till cellcykelanalys" (PDF, 0,5 MB) . Phoenix Flow Systems, Inc. Hämtad 2010-05-20 .