Arrhenius tomt
I kemisk kinetik visar en Arrhenius-plot logaritmen för en reaktionshastighetskonstant , ( , ordinataaxel ) plottad mot reciprok av temperaturen ( , abskissa ). Arrhenius-plottar används ofta för att analysera effekten av temperatur på hastigheten för kemiska reaktioner. För en enkel hastighetsbegränsad termiskt aktiverad process ger ett Arrheniusdiagram en rät linje, från vilken aktiveringsenergin och den preexponentiella faktorn båda kan bestämmas.
Arrhenius- ekvationen kan ges i formen
var
- = hastighetskonstant
- = pre-exponentiell faktor
- = (molär) aktiveringsenergi
- = gaskonstant , ( där är Avogadro-konstanten ) .
- = aktiveringsenergi (för en enstaka reaktionshändelse)
- = Boltzmann konstant
- = absolut temperatur
Den enda skillnaden mellan de två uttrycksformerna är kvantiteten som används för aktiveringsenergin: den förra skulle ha enheten joule / mol , vilket är vanligt inom kemi, medan det senare skulle ha enheten joule och skulle vara för en molekylreaktion händelse, vilket är vanligt inom fysiken. De olika enheterna redovisas genom att använda antingen gaskonstanten eller Boltzmann-konstanten .
Att ta den naturliga logaritmen för den tidigare ekvationen ger
När det plottas på det sätt som beskrivits ovan kommer värdet på y-avsnittet (vid ) att motsvara , och linjens lutning blir lika med . Värdena för y-avskärning och lutning kan bestämmas från de experimentella punkterna med hjälp av enkel linjär regression med ett kalkylblad .
Den pre-exponentiella faktorn, , är en empirisk proportionalitetskonstant som har uppskattats av olika teorier som tar hänsyn till faktorer som kollisionsfrekvensen mellan reagerande partiklar, deras relativa orientering och aktiveringsentropin .
Uttrycket representerar andelen av de molekyler som finns i en gas som har energier lika med eller överstiger aktiveringsenergi vid en viss temperatur. I nästan alla praktiska fall är så att denna fraktion är mycket liten och ökar snabbt med . Följaktligen ökar reaktionshastighetskonstanten snabbt med temperaturen , som visas i det direkta diagrammet av mot . (Matematiskt, vid mycket höga temperaturer så att k skulle plana ut och närma sig som en gräns , men det här fallet inträffar inte under praktiska förhållanden.)
Arbetat exempel
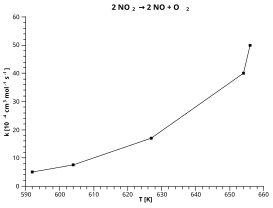
Detta exempel använder sönderfallet av kvävedioxid : 2 NO 2 → 2 NO + O 2
Baserat på den röda "linjen för bästa passform" som plottas i grafen ovan:
- Låt y = ln(k[10 −4 cm 3 mol −1 s −1 ])
- Låt x = 1/T[K]
Poäng avlästa från grafen:
- y = 4,1 vid x = 0,0015
- y = 2,2 vid x = 0,00165
Lutningen på röd linje = (4,1 - 2,2) / (0,0015 - 0,00165) = -12 667
Skärning [ y-värde vid x=0 ] av röd linje = 4,1 + (0,0015 x 12667) = 23,1
Infoga dessa värden i formuläret ovan:
ger:
som visas i handlingen till höger.
för:
- k i 10 −4 cm 3 mol −1 s −1
- T i K
Ersätter kvoten i exponenten för :
- -E a / R = -12 667 K
- ungefärligt värde för R = 8,31446 J K −1 mol −1
Aktiveringsenergin för denna reaktion från dessa data är då:
- Ea = R x 12 667 K = 105 300 J mol -1 = 105,3 kJ mol -1 .