Tarmassocierad lymfoid vävnad
| Tarm-associerad lymfoid vävnad | |
|---|---|
| Detaljer | |
| Systemet | Lymfsystemet |
| Identifierare | |
| Akronym(er) | GALT |
| FMA | 62820 |
| Anatomisk terminologi | |
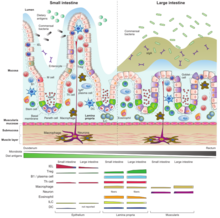
Tarmassocierad lymfoid vävnad ( GALT ) är en komponent i den slemhinneassocierade lymfoidvävnaden (MALT) som arbetar i immunsystemet för att skydda kroppen från invasion i tarmen .
På grund av sin fysiologiska funktion i födoupptaget är slemhinnan tunn och fungerar som en permeabel barriär mot kroppens inre. På samma sätt skapar dess bräcklighet och permeabilitet sårbarhet för infektion och i själva verket använder den stora majoriteten av de smittämnen som invaderar människokroppen denna väg. Den funktionella betydelsen av GALT i kroppens försvar beror på dess stora population av plasmaceller , som är antikroppsproducenter , vars antal överstiger antalet plasmaceller i mjälte , lymfkörtlar och benmärg tillsammans. GALT utgör cirka 70 % av immunsystemet i vikt; nedsatt GALT kan avsevärt påverka styrkan hos immunsystemet som helhet.
Strukturera
Den tarmassocierade lymfoidvävnaden ligger i hela tarmen och täcker en yta på cirka 260–300 m 2 . För att öka ytan för absorption, är tarmslemhinnan uppbyggd av fingerliknande utsprång ( villi ), täckta av ett monolager av epitelceller , som separerar GALT från lumen tarmen och dess innehåll. Dessa epitelceller är täckta av ett lager av glykokalyx på sin luminala yta för att skydda cellerna från surt pH. [ citat behövs ]
Nya epitelceller härrörande från stamceller produceras ständigt på botten av tarmkörtlarna, vilket regenererar epitelet (epitelcellernas omsättningstid är mindre än en vecka). Även om konventionella enterocyter i dessa krypter är den dominerande typen av celler, kan Paneth-celler också hittas. Dessa finns på botten av krypterna och frigör ett antal antibakteriella ämnen, bland dem lysozym, och tros vara inblandade i kontrollen av infektioner. [ citat behövs ]
Under dem finns det ett underliggande lager av lös bindväv som kallas lamina propria . Det finns också lymfcirkulation genom vävnaden som är ansluten till de mesenteriska lymfkörtlarna .
Både GALT och mesenteriska lymfkörtlar är platser där immunsvaret startas på grund av närvaron av immunceller genom epitelcellerna och lamina propria .
GALT inkluderar också Peyers fläckar i tunntarmen , isolerade lymfoida folliklar som finns i hela tarmen och blindtarmen hos människor.
Följande exempel omfattar lymfoida vävnader som fungerar som gränssnitt mellan immunsystemet och inkommande antigener antingen som matantigener eller som patogena eller kommensala mikrobiotas antigener: [ citat behövs ]
- Waldeyers tonsillring
- Små lymfoida aggregat i matstrupen
- Lymfoid vävnad som ackumuleras med åldern i magen
- Peyers plåster i tunntarmen
- Diffust fördelade lymfoida celler och plasmaceller i lamina propria i tarmen
- Intraepiteliala lymfocyter ( IELs ) insprängda i epitelskiktet av slemhinneytor
- Lymfoida aggregat i blindtarmen och tjocktarmen
- Mesenteriska lymfkörtlar dränerar lymf som kommer från tarmvävnaden
GALT kan också delas in i två kategorier med tanke på strukturen som funktionen härrör från. Det finns 1.) organiserad GALT som består av folikler – såsom Peyers plåster, mesenteriska lymfkörtlar och ännu mer organiserad appendix. Dess huvudsakliga funktion är att framkalla immunreaktion. 2.) diffus GALT med enstaka T- och B-celler, makrofager, eosinofiler, basofiler och mastceller, som företrädesvis finns i lamina propria. Denna del av GALT består av mogna effektorceller redo att utföra sina handlingar. [ citat behövs ]
GALT har beskrivits i den vuxna östgrå kängurun ( Macropus giganteus ), tammarwallaby ( Notamacropus eugenii ), randig dunnart ( Sminthopsis macroura ) och rödstjärtad phascogale ( Phascogale calura ). Den vuxna nordbruna bandicooten ( Isoodon macrourus ) har beskrivits ha både organiserad och diffus GALT.
Utvecklingen av GALT har också beskrivits hos flera pungdjursarter, inklusive tammarwallabies, randiga dunnarts ( Sminthopsis macroura ) och rödstjärtade phascogales
Peyers plåster
Peyers plåster är ett aggregat av lymfoida celler som projiceras till lumen i tarmen som fungerar som en mycket viktig plats för initiering av immunsvaret. Den bildar en subepitelial kupol där ett stort antal B-cellsfolliklar med dess germinala centra, T-cellsområden mellan dem i ett mindre antal och dendritiska celler finns. I detta område är den subepiteliala kupolen separerad från tarmens lumen av ett lager av follikelassocierat epitel. Denna innehåller konventionella tarmepitelceller och ett litet antal specialiserade epitelceller som kallas mikroveckceller (M-celler) däremellan. Till skillnad från enterocyter uppvisar dessa M-celler en veckad luminal yta istället för mikrovilli, utsöndrar inte matsmältningsenzymer eller slem och saknar en tjock yta av glycocalix, så det kan vara i kontakt med mikrobiota och antigener som finns i innehållet i tarmen. [ citat behövs ]
Fungera
Under normala omständigheter behöver hela organismens immunsystem en tarmkälla av antigener för att träna och reglera utvecklingen av olika immunceller. Utan att ha sådan stimulering utvecklas inte många egenskaper hos immunsystemet, som det visas på fallet med bakteriefria djur. Eftersom immunceller är i konstant kontakt med bakteriella antigener och födoämnesantigener, är det primära svaret inställt som tolerogent. Det måste fortfarande finnas ett robust försvar i ett fall där patogener passerar antingen epitelets gräns eller producerar skadliga ämnen som bakteriella toxiner. En sådan gång på kanten av en kniv säkerställs av olika typer av immunceller:
B-lymfocyter
Plasma B-celler som finns vid lamina propria producerar höga nivåer av specifika sekretoriska IgA- antikroppar. Dessa IgA utsöndras i lumen i tarmen genom epitelskiktet genom transcytos. För det första binder epitelceller en dimer av IgA via polymer Ig-receptor på den basolaterala sidan och transporterar den i en vesikel in i det luminala utrymmet. Sedan klyvs receptorn proteolytiskt och dimeren av IgA frisätts med en del av receptorn som kallas den sekretoriska komponenten . Den sekretoriska komponenten skyddar utsöndrade antikroppar mot matsmältningsmiljön i tarmen.
En hög nivå av sekretoriskt IgA är ett resultat av interaktionen mellan B-celler och intestinala antigenpresenterande dendritiska celler (DC) i samarbete med follikulära T-hjälparceller (Tfh) i de germinala centra (GCs) i Peyers plåster. Det finns två huvudsakliga sätt för IgA-produktion 1) T-cellsberoende vilket resulterar i sIgAs med hög affinitet och specificitet och 2) T-cellsoberoende generering av sIgA, som använder dendritiska celler och deras produktion av BAFF- och APRIL-cytokiner. T-cells oberoende producerade sIgAs har lägre affinitet och täcker huvudsakligen kommensaler. Allmänna funktioner för sekretoriska IgA är att belägga någon av tarmbakterierna (kommensala eller patogena) för att försämra deras motilitet och förhindra att de kommer i långvarig och direkt kontakt med tarmepitelet och värdens tarmens immunsystem. Detta kallas immunförsvar. Utsöndrade IgAs binder till bakteriella toxiner och neutraliserar dem också.
T-lymfocyter
Naiva CD4+T-celler differentierar sig till Treg eller olika undergrupper av T-hjälparceller (Th1, Th2, Th17 eller Tfh). I den tarmassocierade lymfoida vävnaden sker differentieringsprocessen genom presentation av antigener som härrör från tarmmikrobiota av antigenpresenterande celler såsom dendritiska celler eller M-celler i Peyers plåster. En typisk process för oral tolerans mot intagna matantigener kan beskrivas som kontinuerlig luminal provtagning av antigener av DC och deras efterföljande migrering följt av priming av naiva T-celler i mesenteriska lymfkörtlar för att bli immunsuppressiva T-celler (Treg). Antigener som tas emot på detta sätt säkerställer tolerans mot dem. Kommensal mikrobiota aktiverar också immunsvaret - på ett sätt som skyddar värdtarmvävnaden från att skada den av immuncellsreaktioner. Det slutliga resultatet av T-cellspopulationer hos friska individer skiljer sig från spektrumet av T-celler som är ett resultat av akut infektion eller kronisk inflammation. Olämplig stimulering (typiskt av segmenterade filamentösa bakterier - SFB ) av kronisk Th1- eller Th17-cellsvar spelar en avgörande roll vid patologisk skada på värden.
Flera nya tarmassocierade lymfoida celler har beskrivits. De har olika ursprung och följer olika mognadsprocesser men delar samma GALT-roll – att snabbt reagera på patogener och utsöndra effektorcytokiner. Sådana flerskiktiga skyddssystem framhäver känsligheten hos slemhinnor för invaderande medel. Slemhinnan är det vanligaste sättet att ta sig in av patogena infektioner i värden. Robust engagemang av en mängd olika lymfoida celler som patrullerar epitelskiktet återspeglar också evolutionärt tryck och kapprustning mellan immunsystem och patogener som undkommer dess kontroll.
Intraepiteliala lymfocyter (IEL)
Långlivade intraepiteliallymfocyter och bostadslymfocyter är en av de största populationerna av T-lymfocyter i kroppen. I motsats till andra perifera lymfocyter cirkulerar IEL inte i blodomloppet eller lymfsystemet utan finns i epitelskiktet i tarmen. En sådan plats är mycket speciell i sig - IELs patrullerar tillståndet inom ett enda lager av celler och har dendritiskt utseende. De tillhandahåller den första försvarslinjen i händelse av att patogen passerar epitelbarriären. IELs omfattar överraskande mångfald av ursprung och delas in i två huvudkategorier - konventionella och icke-konventionella. Den är baserad på molekylära ytegenskaper och den plats där de förvärvar sitt slutliga effektorcytotoxiska program.
Konventionella IELs bär klassisk TCR-receptor gjord av α- och β-subenhet tillsammans med CD4- eller CD8-co-receptorer. De representerar en relativ minoritet av de totala intestinala IELs jämfört med okonventionella IELs. De härrör från naiva T-celler som möter antigener i periferin (typiskt antigener som visas av DC i Peyers plåster). Efter denna aktivering uttrycker konventionella IEL: er tarm-tropiska molekyler som gör att de kan komma hem i tarmvävnaden efter att ha transporterats genom lymfströmmen och efterföljande blodström. Konventionella intraepitelceller är sålunda vävnadsbosatta effektorminnes-T-celler, som snabbt kan svara med cytolytisk aktivitet och frisättning av cytokiner såsom INFy och TNF.
Okonventionella IEL presenterar majoriteten av IEL-celler i tarmepitelskiktet och förvärvar deras effektorprogram efter att ha lämnat tymus som naiva celler och stött på antigener i GALT. Efter sådan stimulering finns okonventionella IELs (huvudsakligen γδ T-celler ) i tarmepitelet. γδ T-celler uttrycker TCR-receptor gjord av y- och δ-subenhet och känner inte igen antigenpeptider som presenteras i den MHC-bundna formen. Processen för deras aktivering är fortfarande i stort sett okänd. Huvudegenskapen hos γδ T-celler är bildandet av långlivade minnespopulationer i barriärvävnader såsom tarmepitel eller i huden. De utför immunminne i speciell vävnad även efter eliminering av patogen eller reträtt av inflammation.
Medfödda lymfoida celler (ILC)
Medfödda lymfoida celler (ILC) är den senast upptäckta familjen av medfödda immunceller och termen "medfödda" betyder att de inte behöver omarrangera antigenreceptorgenen. På grund av utvecklingen av en ny metod, såsom encells-RNA-sekvensering, beskrivs subtyper av medfödda lymfoida celler. Baserat på deras transkriptionsprofil inställd av huvudsakliga transkriptionsfaktorer är ILC:er indelade i fem distinkta undergrupper: NK-celler, ILC1s, ILC2s, ILC3s och LTi-celler. ILC är vanliga på slemhinneytor och spelar en nyckelroll i slemhinneimmunitet och homeostas på grund av deras förmåga att snabbt utsöndra immunreglerande cytokiner och därmed kommunicera med andra immunceller.
Medfödd immunitet
Förutom adaptiv specifik immunitet spelar en medfödd immunitet en betydande roll i GALT eftersom den ger snabbare svar. Igenkänning av mikrobiell icke-självsignatur sker av mönsterigenkänningsreceptorer (PRR) som kan hittas på dendritiska celler, makrofager, monocyter, neutrofiler och epitelceller. PRR binder till konserverade mikrobiella mönster som cellväggskomponenter (LPS, teikosyra, flagellin, peptidoglykan) eller viral eller bakteriell nukleinsyra. PRR är lokaliserade extracellulärt som membranbundna receptorer (Toll-liknande receptorer) eller intracellulärt (NOD-liknande och RIG-liknande receptorer). Varierad palett av mönsterigenkänningsreceptorer aktiveras av olika signaler som kallas PAMP (patogenassocierade molekylära mönster) eller av signaler kopplade till vävnadsskada som heter DAMP (skadaassocierade molekylära mönster).
Makrofager
Majoriteten av antigenpresenterande celler (APC) i tarmen kommer från makrofager, som har mycket snabb omsättning. Makrofager är vanliga i lamina propria och submukosala djupare lager som muscularis lager. Makrofager kan använda sina transepiteliala dendriter (långa cytoplasmatiska förlängningar) och direkt komma i kontakt med epitelskiktet och prov på luminala bakterier. Under friska förhållanden uppslukar makrofager kommensala bakterier och omgivande cellrester, utsöndrar IL-10, driver mognad av Treg och bidrar till vävnadshomeostas. På grund av lågt uttryck av medfödda svarsreceptorer och samstimulerande ytmolekyler, initierar inte intestinala makrofager inflammation. Men vid infektion eller inflammation förändras makrofagernas profil och de börjar utsöndra stora mängder TNF- α och blir proinflammatoriska effektorceller.
Dendritiska celler
DCs utgör mindre än 10 % av lamina propria APC och ligger vanligtvis inte i lägre lager. Inneboende produktion av retinsyra och TGF-β (typiskt för tarmassocierade DC) inducerar uttryck av tarmsökande molekyler och gynnar IgA-växling under mognad av B-celler i folikler. DCs styr också Treg och konventionella IELs att ta emot sin slutliga fenotyp av mogna effektorceller i tarmen.
Andra djur
Den adaptiva immuniteten , medierad av antikroppar och T-celler , finns bara hos ryggradsdjur . Medan alla av dem har en tarmassocierad lymfoid vävnad och de allra flesta har en version av mjälte och tymus , visar inte alla ryggradsdjur benmärg , lymfkörtlar eller groddcentrum , vilket betyder att inte alla ryggradsdjur kan generera lymfocyter i benmärgen. Denna olika fördelning av de adaptiva organen i de olika grupperna av ryggradsdjur antyder GALT som den allra första delen av det adaptiva immunsystemet hos ryggradsdjur. Det har föreslagits att från denna befintliga GALT, och på grund av trycket från kommensala bakterier i tarmen som utvecklades tillsammans med ryggradsdjur, uppträdde senare specialiseringar som tymus, mjälte eller lymfkörtlar som en del av det adaptiva immunsystemet .
Ytterligare bilder
externa länkar
- Histologibild: 12502loa – Histology Learning System vid Boston University - "Digestive System: Matsmältningskanalen: kolon , taenia coli "
- Histologibild: 11102loa – Histology Learning System vid Boston University - "Digestive System: Matsmältningskanalen: esophageal/mage junction"