Svaveloxosyra
Svaveloxosyror är kemiska föreningar som innehåller svavel , syre och väte . Den mest kända och viktigaste industriellt använda är svavelsyra . Svavel har flera oxosyror ; några av dessa är dock kända endast från deras salter (dessa visas i kursiv stil i tabellen nedan). De syror som har karakteriserats innehåller en mängd olika strukturella egenskaper, till exempel:
- tetraedriskt svavel när det är koordinerat till syre
- terminala och överbryggande syreatomer
- terminala peroxogrupper
- terminal S=S
- kedjor av (−S−) n
| Syra | Formel | Formellt oxidationsnummer | Strukturera | Besläktade anjoner | Anteckningar |
|---|---|---|---|---|---|
| Svavelsyra | H 2 SO 4 | +6 |
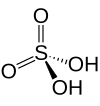
|
Sulfat , SO 2− 4 och vätesulfat, allmänt känt som bisulfat , HSO − 4 |
Mest kända och industriellt betydelsefulla. |
| Polysvavelsyror inklusive disulfuric syra (pyrosvavelsyra) | H 2 SO 4 · n SO 3 | +6 |

|
Disulfat (allmänt känt som pyrosulfat ), S 2 O 2− 7 och trisulfat, S 3 O 2− 10 |
Ren svavelsyra smälter vid 36 °C. Finns i rykande svavelsyra, oleum . Exempel kända för n = 1 och n = 2. |
| Peroximonosvavelsyra | H 2 SO 5 | +6 |
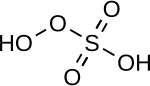
|
Peroxomonosulfat , OOSO 2−3 _ |
"Caros syra", ett fast ämne som smälter vid 45 °C |
| Peroxidisvavelsyra | H2S2O8 _ _ _ _ _ | +6 |

|
Peroxidisulfat , O 3 SOOSO 2− 3 |
"Marshalls syra", ett fast ämne som smälter vid 65 °C. |
| Ditionsyra | H2S2O6 _ _ _ _ _ | +5 |

|
Ditionat , O 3 SSO 2− 3 |
Ej isolerade i ren form, endast koncentrerade lösningar har framställts |
| Tiosvavelsyra | H2S2O3 _ _ _ _ _ | 0 (för det terminala svavlet), +4 (för den centrala atomen) |

|
Tiosulfat , S 2 O 2− 3 Hydrogentiosulfat HS 2 O − 3 (ammoniumsalt framställt i vattenfri metanol vid −80 °C) |
Vattenlösningar sönderdelas. |
| Disulfurous syra eller pyrosulfurous syra | H2S2O5 _ _ _ _ _ | +5 (av svavelatomen bunden till 3 syreatomer), +3 (av annan svavelatom) |

|
Disulfit allmänt känd som metabisulfit , S 2 O 2− 5 |
Okänt. |
| Svavelsyra | H 2 SO 3 | +4 |
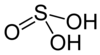
|
Bisulfit , HSO − 3 och sulfit , SO 2− 3 |
Okänt. |
| Ditionsyra | H2S2O4 _ _ _ _ _ | +3 |

|
Ditionit , O 2 SSO 2− 2 |
Okänt. |
| Sulfoxylsyra | H 2 SO 2 | +2 |
|
Sulfoxylat , SO 2−2 _ |
Fri syra okänd |
| Polytionsyra | H 2 S x O 6 | 0 (för de överbryggande S-atomerna), +5 (för de terminala centrala S-atomerna) |

|
Polytionater, O 3 S(S x −2 )SO 2− 3 . Exempel tritionat , tetrationat , pentationat, hexationat, heptationat, oktationat, nonationat, dekationat, undekationat, dodekationat, tridekationat och tetratationat. |
Exempel kända med x = 3, 4, 5, 6, 7, 8, 10, 12, 14. |
| Tiosvavelsyra | H2S2O2 _ _ _ _ _ | −1 (för den yttre svavelatomen), +3 (för den centrala atomen) |
|
Tiosulfiter | Okänt |
| Dihydroxidisulfan | H2S2O2 _ _ _ _ _ | +1 |
|
Syra känd |
Se även
externa länkar
- Svavel+syror vid US National Library of Medicine Medical Subject Headings (MeSH) Svaveloxosyror tillsammans med andra syror som innehåller svavel
Kategorier: