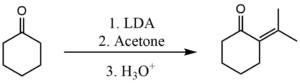Självkondensering
Självkondensation är en organisk reaktion där en kemisk förening som innehåller en karbonylgrupp fungerar både som elektrofil och nukleofil i en aldolkondensation . Det kallas också en symmetrisk aldolkondensation i motsats till en blandad aldolkondensation där elektrofilen och nukleofilen är olika arter.
Till exempel kondenserar två acetonmolekyler till en enda förening mesityloxid i närvaro av ett jonbytarharts :
- 2 CH3COCH3 → (CH3 ) 2C = CH ( CO ) CH3 + H2O
För syntetiska användningar är detta i allmänhet en oönskad, men spontan och gynnsam bireaktion av blandad aldolkondensation, och speciella försiktighetsåtgärder krävs för att förhindra det.
Förhindrar självkondensering
I många fall är självkondensering en oönskad sidoreaktion. Därför har kemister antagit många sätt att förhindra att detta inträffar när de utför en korsad aldolreaktion.
Användningen av en mer reaktiv elektrofil och en icke-enoliserbar partner
Om acetofenon och bensaldehyd sätts samman i närvaro av vattenhaltig NaOH bildas endast en produkt:
Detta beror på att bensaldehyd saknar några enoliserbara protoner, så den kan inte bilda ett enolat, och bensaldehyden är mycket mer elektrofil än någon oenoliserad acetofenon i lösning. Därför kommer enolatet som bildas av acetofenon alltid att angripa bensaldehyden framför en annan molekyl av acetofenon.
Att göra enolatjoner kvantitativt
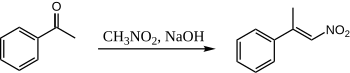
När nitrometan och acetofenon kombineras med vattenhaltig NaOH, bildas endast en produkt:
Här får acetofenonen aldrig en chans att kondensera med sig själv, eftersom nitrometanet är så mycket surare att nitro-"enolatet" tillverkas kvantitativt. Det finns ingen känd publicerad procedur för kondensation mellan acetofenon och nitrometan.
En liknande process kan också användas för att förhindra självkondensering mellan två ketoner. I det här fallet måste dock basen som används vara mer kraftfull. En vanlig bas som används är litiumdiisopropylamid (LDA). Här används den för att utföra den korsade kondensationen mellan aceton och cyklohexanon .
Deprotoneringssteget med LDA är så snabbt att det bildade enolatet aldrig får en chans att reagera med några oreagerade molekyler av cyklohexanon. Då reagerar enolatet snabbt med aceton.
Silylenoleterbildning
Att använda LDA fungerar inte när man försöker göra enolatjoner från aldehyder. De är så reaktiva att självkondensering kommer att uppstå. Ett sätt att komma runt detta är att omvandla aldehyden till en silylenoleter med hjälp av trimetylsilylklorid och en bas, såsom trietylamin , och sedan utföra aldolkondensationen. Här används denna taktik vid kondensation av acetaldehyd och bensaldehyd . En Lewis-syra TiCl4 , såsom , måste användas för att främja kondensation.
- ^ Ketonkondensationer som använder sulfonsyrajonbytarharts N. Lorette; J. Org. Chem. ; 1957; 22(3); 346-347.
- ^ Clayden, Jonathan. Organisk kemi. Oxford University Press, Oxford, New York, s. 689-720. ISBN 978-0-19-850346-0
- ^ Clayden, Jonathan. Organisk kemi. Oxford University Press, Oxford, New York, s. 689-720. ISBN 978-0-19-850346-0
- ^ Clayden, Jonathan. Organisk kemi. Oxford University Press, Oxford, New York, s. 689-720. ISBN 978-0-19-850346-0