ST sväng
ST -svängen är en strukturell egenskap i proteiner och polypeptider . Var och en består av tre aminosyrarester (märkta i , i + 1 och i + 2) där rest i är ett serin (S) eller treonin (T) som bildar en vätebindning från sin sidokedjas syregrupp till huvudkedjans NH-grupp i återstod i + 2.
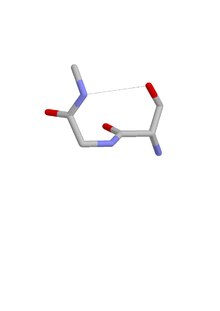
Liknande motiv förekommer med aspartat eller asparagin som rest i , kallad asx turn . Fyra typer av asx-sväng och ST-sväng kan urskiljas: typ I, I', II och II'. Dessa kategorier motsvarar (via sidokedja-huvudkedjemimik av rest i) de av de mer förekommande vätebundna beta-varven , som har fyra rester och en vätebindning mellan CO för rest i och NH för rest i + 3. Angående deras förekomst i proteiner, skiljer de sig genom att typ I är den vanligaste av de fyra beta-varven medan typ II' är den vanligaste av ST- och asx-varven.
Asx- och ST-vändningar förekommer båda ofta vid N-ändarna av α-helixar , som en del av asx-motiv eller ST-motiv , med asx, serin eller treonin som N-cap- resten. De betraktas därför ofta som spiralskyddsfunktioner.
Bevis för en funktionellt relevant ST-sväng tillhandahålls i CDR3-regionen av T-cellsreceptorn (B-kedja, V-domän)
En del av ST-varven åtföljs av en vätebindning mellan huvudkedjan och huvudkedjan som kvalificerar dem som ST-motiv .