Promoter bashing
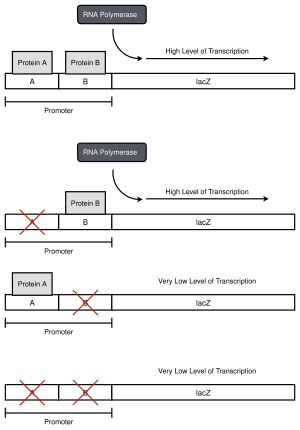
Promotorbashing av en hypotetisk tvåregionspromotor. Promotorn klonas uppströms om lacZ- reportergenen . Punktmutationer som inaktiverar varje region görs (de röda Xen) och regionen klonas på en plasmid och infogas i E. coli- celler, växer upp och har närvaron av reporter mätt. Bindningen av protein B i detta exempel är nödvändig för att RNA-polymeras ska binda och initiera transkription . I en laboratoriemiljö är det kanske inte känt att promotorn består av två regioner - enstaka mutationer kan göras längs promotorn, promotorn kan sekvenseras och nivåerna av reporter analyseras för att hitta gränser för varje region.
Promotorbashing är en teknik som används inom molekylärbiologi för att identifiera hur vissa regioner av en DNA-sträng , vanligtvis promotorer , påverkar transkriptionen av nedströms gener. Under normala omständigheter proteiner till promotorn och aktiverar eller undertrycker transkription. I en promotorbashing- analys görs specifika punktmutationer eller deletioner i specifika regioner av promotorn och transkriptionen av genen mäts sedan. Bidraget från en region av promotorn kan observeras av transkriptionsnivån. Om en mutation eller deletion förändrar transkriptionsnivån är det känt att den regionen av promotorn kan vara ett bindningsställe eller annat regulatoriskt element.
Promotorbashing görs ofta med deletioner från antingen 5'- eller 3' -änden av DNA-strängen; denna analys är lättare att utföra baserat på upprepad restriktionsuppslutning och gelrenande fragment av specifika storlekar. Det är ofta enklast att ligera promotorn in i reportern, generera en stor mängd av reporterkonstruktionen med PCR eller tillväxt i bakterier och sedan utföra seriella restriktionsdigeringar på detta prov. Förmågan hos uppströmspromotorer kan enkelt analyseras genom att ta bort segment från 5'-änden, och samma sak för 3'-änden av strängen för nedströmspromotorer.
Eftersom promotorn vanligtvis innehåller bindningssekvenser för proteiner som påverkar transkription, är dessa proteiner också nödvändiga när man testar effekterna av promotorn. Proteiner som associerar med promotorn kan identifieras med användning av en elektroforetisk mobilitetsförskjutningsanalys (EMSA), och effekterna av inkludering eller uteslutning av proteinerna med de mutageniserade promotorerna kan bedömas i analysen. Detta tillåter användningen av promotorbashing för att inte bara upptäcka platsen på DNA-strängen som påverkar transkriptionen, utan även proteinerna som påverkar den strängen. Effekterna av proteininteraktioner med varandra såväl som bindningsställena kan också analyseras på detta sätt; kandidatproteiner måste istället identifieras med protein/protein-interaktionsanalyser istället för en EMSA.
Procedur
Detta är ett exempel på procedur för en promotorbashing-analys, anpassad från Boulin et al. :
- Klona DNA-regionen som anses fungera som en promotor. Kloning är nödvändigt för analysen eftersom den säkerställer att promotorn är den enda faktorn som påverkar uttrycket. Detta steg involverar ofta extraktion av DNA från organismen den finns i och PCR- amplifiering.
- Sekvensera regionen. DNA-sekvensering är nödvändig för att identifiera skillnader i muterade promotorer från vildtypspromotorn och för att korrelera dessa skillnader med skillnader i genuttryck. Dessutom hjälper det till med restriktionssmältningen av regionen.
- Digerera med lämpliga restriktionsendonukleaser. Regionen kan smältas för att avlägsna element som inte anses vara en del av promotorn. Dessutom måste reportergenen infogas på ett visst avstånd från promotorn för de flesta promotorer. I vissa metoder för promotorbashing används multipla restriktionsdigeringar för att systematiskt ta bort element från promotorerna - den här metoden säkerställer att regionerna av promotorn som tas bort inte bidrar till reporteruttryck .
- Mutagenisera promotorn. Att mutera promotorn är nödvändig om metoden för att avlägsna en del av promotorn med restriktionsuppslutning inte används. Många muterade strängar kan genereras och strängarna sekvenseras och promotorernas aktiviteter analyseras. Detta är ofta nödvändigt eftersom en mutation inte kan garanteras inaktiverar ett bindningsställe. Icke-riktad PCR-baserad mutagenes kan också användas; parametrarna för den mutagena PCR-reaktionen kan justeras för att introducera ett rimligt antal mutationer. Den slumpmässiga naturen hos PCR kräver dock att fler strängar analyseras nedströms om detta steg.
- Ligera till reportergenen. Promotorerna som ska analyseras måste ligeras till en reportergen så att genuttrycksnivåer kan mätas. Reportergenen måste vara tillräckligt långt från promotorn för att promotorn påverkar den, eftersom en vildtypspromotor skulle påverka en gen. Detta kan verifieras med den positiva kontrollen (full promotor).
- Transformera celler av intresse med de olika promotor:reporter-konstruktionerna. Promotor- och reporterkonstruktionerna måste ligeras in i en plasmid och transformeras till celler i vilka den plasmiden kan uttryckas för att mäta aktiviteten av varje promotorsekvens. Proteiner som påverkar promotorn måste också läggas till dessa celler - ofta placeras dessa proteiner på samma eller olika plasmid under reglering av en konstitutivt aktiv promotor.
- Mät reporter-gen-transkriptionshastigheter. Genprodukterna analyseras och hastigheterna för reportertranskription mäts.
Från data som erhållits från analys av de olika promotorerna kan effekterna av olika delar av promotorn fastställas. Det är dock möjligt att det inte finns tillräckligt med data och analysen måste köras om med en annan promotorregion och/eller olika mutationer.