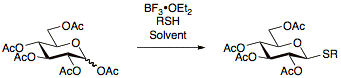Kemisk glykosylering
En kemisk glykosyleringsreaktion involverar kopplingen av en glykosyldonator till en glykosylacceptor som bildar en glykosid . Om både donatorn och acceptorn är sockerarter är produkten en oligosackarid . Reaktionen kräver aktivering med ett lämpligt aktiverande reagens. Reaktionerna resulterar ofta i en blandning av produkter på grund av skapandet av ett nytt stereogent centrum vid den anomera positionen av glykosyldonatorn. Bildandet av en glykosidbindning möjliggör syntes av komplexa polysackarider som kan spela viktiga roller i biologiska processer och patogenes och därför möjliggör syntetiska analoger av dessa molekyler ytterligare studier med avseende på deras biologiska betydelse.
Terminologi
Glykosyleringsreaktionen involverar kopplingen av en glykosyldonator och en glykosylacceptor via initiering med användning av en aktivator under lämpliga reaktionsbetingelser.
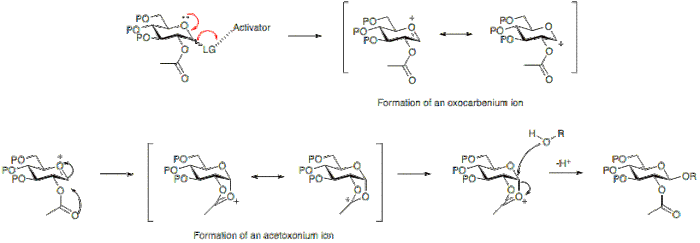
- En glykosyldonator är ett socker med en lämplig lämnande grupp vid den anomera positionen. Denna grupp, under reaktionsbetingelserna, aktiveras och via bildandet av ett oxokarbenium elimineras vilket lämnar ett elektrofilt anomert kol.
- En glykosylacceptor är ett socker med en oskyddad nukleofil hydroxylgrupp som kan angripa kolet i oxokarbeniumjonen som bildas under reaktionen och möjliggöra bildandet av den glykosidiska bindningen.
En aktivator är vanligtvis en Lewis-syra som gör det möjligt för den lämnande gruppen i den anomera positionen att lämna och resulterar i bildandet av oxokarbeniumjonen.
Stereokemi
Bildandet av en glykosidbindning resulterar i bildandet av ett nytt stereogent centrum och därför kan en blandning av produkter förväntas resultera. Den bildade kopplingen kan antingen vara axiell eller ekvatorial (a eller p med avseende på glukos). För att bättre förstå detta måste mekanismen för en glykosyleringsreaktion övervägas.
Granngruppsdeltagande
Det stereokemiska resultatet av en glykosyleringsreaktion kan i vissa fall påverkas av typen av skyddsgrupp som används i position 2 hos glykosyldonatorn. En deltagande grupp, typiskt en med en karboxylgrupp närvarande, kommer övervägande att resultera i bildningen av en p-glykosid. Medan en icke-deltagande grupp, en grupp vanligtvis utan en karboxylgrupp, ofta kommer att resultera i en a-glykosid.
Nedan kan det ses att en acetylskyddsgrupp i position 2 möjliggör bildning av en acetoxoniumjonmellanprodukt som blockerar angrepp på ringens bottenyta och därför tillåter bildningen av p-glykosiden övervägande.
Alternativt tillåter frånvaron av en deltagande grupp på position 2 antingen attack från botten eller toppen. Eftersom a-glykosidprodukten kommer att gynnas av den anomera effekten , dominerar vanligtvis a-glykosiden.
Att skydda grupper
Olika skyddsgrupper på antingen glykosyldonatorn eller glykosylacceptorn kan påverka reaktiviteten och utbytet av glykosyleringsreaktionen. Typiskt elektronbortdragande grupper såsom acetyl- eller bensoylgrupper minska reaktiviteten hos donatorn/acceptorn och kallas därför "avväpnande" grupper. Elektrondonerande grupper såsom bensylgruppen har visat sig öka reaktiviteten hos donatorn/acceptorn och kallas därför "armerande" grupper.
Aktuella metoder för glykosidsyntes
Glykosyljodider
Glykosyljodider introducerades först för användning i glykosyleringsreaktioner 1901 av Koenigs och Knorr, även om de ofta ansågs vara alltför reaktiva för syntetisk användning. Nyligen har flera forskargrupper visat att dessa donatorer har unika reaktiva egenskaper och kan skilja sig från andra glykosylklorider eller bromider med avseende på reaktionstid, effektivitet och stereokemi . Glykosyljodider kan tillverkas under en mängd olika förhållanden, en metod att notera är reaktionen av en 1- O -acetylpyranosid med TMSI.
Jodidgivare kan typiskt aktiveras under grundläggande förhållanden för att ge β-glykosider med god selektivitet. Användningen av tetraalkylammoniumjodidsalter såsom tetrabutylammoniumjodid (TBAI) tillåter anomerisering in situ av a-glykosylhalogeniden till p-glykosylhalogeniden och ger a-glykosiden med god selektivitet.
Tioglykosider
Tioglykosider rapporterades första gången 1909 av Fischer och har sedan dess undersökts ständigt vilket möjliggör utvecklingen av ett flertal protokoll för deras framställning. Fördelen med att använda tioglykosider är deras stabilitet under ett brett spektrum av reaktionsbetingelser som möjliggör skyddande gruppmanipulationer. Dessutom fungerar tioglykosider som temporära skyddsgrupper vid den anomera positionen, vilket gör det möjligt för tioglykosider att vara användbara som både glykosyldonatorer och glykosylacceptorer. Tioglykosider framställs vanligtvis genom att reagera per-acetylerade sockerarter med BF
3 •OEt
2 och lämplig tiol.
Tioglykosider som används i glykosyleringsreaktioner som donatorer kan aktiveras under ett brett spektrum av förhållanden, framför allt med NIS/AgOTf.
Trikloracetimidater
Trikloracetimidater introducerades och utforskades först av Schmidt 1980 och har sedan dess blivit mycket populära för glykosidsyntes. Användningen av trikloracetimidater ger många fördelar inklusive enkel bildning, reaktivitet och stereokemiskt resultat. O -glykosyltrikloracetimidater framställs genom tillsats av trikloracetonitril (
. Cl3CCN ) under basiska betingelser till en fri anomerisk hydroxylgrupp
BF3
• OEt2
aktiverande grupper för glykosyleringsreaktioner med användning av trikloracetimidater är eller TMSOTf .
Kolonnkromatografisk rening av reaktionsblandningen kan ibland vara utmanande på grund av biprodukten av trikloracetamid. Detta kan emellertid övervinnas genom att tvätta det organiska skiktet med 1 M NaOH-lösning i en separertratt före kromatografi. Acetylskyddsgrupper visade sig vara stabila under denna procedur.
Anmärkningsvärda syntetiska produkter
Nedan är några exempel på några anmärkningsvärda mål som erhållits via en serie glykosyleringsreaktioner.
Se även
Böcker
- Brito-Arias, Marco (2022). Syntes och karaktärisering av glykosider (3:e upplagan). Springer. doi : 10.1007/978-3-030-97854-9 . ISBN 978-3-030-97854-9 . S2CID 248302952 .