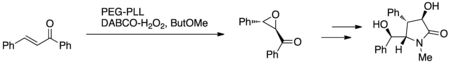Juliá–Colonna-epoxidation
Juliá -Colonna-epoxidationen är en asymmetrisk polyleucin - katalyserad nukleofil epoxidation av elektronbristande olefiner i ett trefasiskt system . Reaktionen rapporterades av Sebastian Juliá vid det kemiska institutet i Sarriá 1980, med ytterligare utarbetande av både Juliá och Stefano Colonna (Istituto di Chimica Industriale dell'Università, Milano, Italien).
I det ursprungliga trefasiska protokollet är chalkonsubstratet lösligt i den organiska fasen, vanligtvis toluen eller koltetraklorid . Den alkaliska väteperoxidoxidanten är löslig primärt i vattenfasen, och reaktionen sker vid det olösliga polymerskiktet vid gränsytan mellan de två faserna. Alternativa bifasiska och monofasiska protokoll har utvecklats med ökad substrattillgänglighet och reaktionshastighet.
Den effektiva enantioselektiva katalytiska epoxideringen under milda förhållanden är av stor syntetisk användbarhet. Epoxider är inte bara effektiva syntoner för en rad transformationer, de har en betydande närvaro i naturliga produktstrukturer. Dessutom har reaktionen effektivt skalats upp till industriellt användbara nivåer, med arbete som framför allt utförts av Bayer och Evonik . Slutligen antyder den enzymliknande aktiviteten hos polyaminosyrasegmenten en roll för reaktionen i livets prebiotiska ursprung .
Reaktionsmekanism
Juliá-Colonna-epoxidationen är en asymmetrisk nukleofil epoxidation av elektronbristande olefiner som α,β-omättade ketoner . Den allmänna mekanismen som visas i figur 2 gäller för alla nukleofila epoxidationer men kontrolleras i denna reaktion av polyleucinkatalysatorn.
Hydroperoxidanjonen och chalkonen samlas i ett komplex med polyleucinkatalysatorn innan de reagerar för att bilda en peroxidenolatmellanprodukt . Mellanprodukten stänger därefter, som kontrolleras av katalysatorstrukturen, för att bilda epoxidprodukten stereoselektivt.
Ternär komplexbildning
Polyleucinsträngarna uppvisar enzymliknande kinetik med ett första ordningens beroende av och eventuell mättnad med både hydroperoxidanjonen (K M = 30 mM) och olefinsubstratet (K M = 110 mM.) Kinetisk studie tyder på att reaktionen fortskrider genom slumpmässig steady-state-bildning av ett ternärt (polyleucin+hydroperoxidanjon+olefin) komplex . Båda substraten måste binda före reaktion, och medan båda kan binda först, är initial hydroperoxidbindning kinetiskt föredragen. Den snabba jämvikten som möjliggör komplexbildning följs av den hastighetsbegränsande bildningen av peroxidenolatet ( Figur 3).
Mekanistiskt ursprung för stereoselektivitet
Alla reaktanter associeras med polyleucinkatalysatorn före reaktion för att bilda hydroperoxidenolatmellanprodukten. Katalysatorn orienterar reaktanterna och, ännu mer signifikant, peroxidenolatmellanprodukten genom en serie vätebindningsinteraktioner med de fyra N-terminala aminogrupperna i polyleucin- a-helixen . Medan andra modeller har föreslagits, har beräkningar av Kelly et al. har föreslagit att NH-2, NH-3 och NH-4 bildar en likbent triangel tillgänglig för vätebindning som ett mellanstabiliserande oxyanjonhål . Även om olefinbindning till antingen endo- eller exoytan av helixen är steriskt tillåten, orienterar endast endobindning NH-4-gruppen så att den binder med hydroperoxiddelen, vilket möjliggör hydroxidförskjutning i det sista reaktionssteget (Figur 4).
Katalysator
Val av polyaminosyror
Enantioselektivitet maximeras av polyaminosyrasekvenser som innehåller det största a-helixinnehållet; dessa inkluderar polyleucin och polyalanin . Både poly-L- och poly-D-aminosyror är tillgängliga och orsakar den motsatta stereoinduktionen.
Katalysatorgenerering

De ursprungliga polyleucinkatalysatorerna bildades genom att reagera leucin-N-karboxianhydrider med en initiator såsom en amin, en alkohol eller vatten (Figur 5). I trefasiska system måste polymerkatalysatorn blötläggas i det organiska lösningsmedlet och peroxidlösningen för att generera en gel före reaktion. – Speciellt i tvåfasiga system kan reaktionstiden reduceras och enantioselektiviteten ökas genom att aktivera katalysatorn med NaOH före reaktionen. Vidare, i tvåfassystem kan polymeren immobiliseras på polystyren , polyetylenglykol (PEG) eller silikagel och formas till en pasta.
Katalysator sekundär struktur
Katalysatorns aktiva komponent antar en a-helixstruktur där de fyra till fem N-terminala resterna är aktivt involverade i katalys. Medan aktiva katalysatorer har genererats från skalemisk leucin, måste konsekvent enantiomerhalt bibehållas genom den N-terminala regionen för att ge strukturen lämplig handenhet. Medan den största enantioselektiviteten ursprungligen observerades när n=30 rester, är en 10-mer leucinpolypeptid tillräckligt lång för att ge signifikant enantioselektivitet. antal tillgängliga N-terminaler per använd massa.
Omfattning
Juliá-Colonna-epoxideringen av elektronbristande olefiner demonstrerades ursprungligen med chalkoner, men den utvidgades snart till andra system med elektronbortdragande delar som α,β-omättade ketoner, estrar och amider. Reaktionen har också visat effektivitet med sulfonsubstrat , och omfattningen av reaktionen utökas med ytterligare metodologisk undersökning.
Flera klasser av substrat är dock inte lämpliga för Juliá–Colonna-epoxidation. Dessa inkluderar:
- föreningar som är känsliga för hydroxid.
- föreningar med sura protoner på α- eller α'-positionerna.
- elektronrika olefiner.
Den nukleofila epoxideringen är naturligt komplementär i omfattning till elektrofila epoxidationer som Sharpless epoxidation och Jacobsen epoxidation .
Stereoselektivitet
Katalysatorstruktur
Stereoinduktionen av Juliá-Colonna-epoxidationen är beroende av den α-spiralformade sekundära strukturen hos polyleucinkatalysatorn. Även om den konsekventa stereokemin av de N-terminala aminosyrorna är nödvändig för denna induktion, är även en 10-mer leucinpolypeptid av tillräcklig längd för att ge signifikant enantioselektivitet.
Kiral amplifiering med skalemiska katalysatorer
Detta beroende enbart av den N-terminala regionen av helixen är mest uttalad vid enantioselektiv stereoinduktion av skalemiska katalysatorer. Till och med ett 40 % enantiomert överskott av L vs. D-leucin vid katalysatorbildning kan ge samma enantiomera anrikade epoxid som den enantiomera katalysatorn. Förhållandet mellan katalysator och produktens enantiorenhet kan nära approximeras med en Bernoulliansk statistisk modell: ee n =(L n -D n )/(L n +D n ) där L och D är proportionerna av L- och D-leucin som används för att generera de katalytiska polymererna och n är längden av den katalytiska komponenten.
Kirala aminosyror, inklusive leucin, har genererats i experiment med elektrisk urladdning utformade för att efterlikna de prebiotiska förhållandena på jorden, och de har hittats i skalemiska blandningar i meteoriter. Det har föreslagits att polyaminosyrafragment som är analoga med Juliá-Colonna-katalysatorn kan ha initierats av imidazol- eller cyanidderivat , och de resulterande fragmenten kan ha spelat en katalytisk roll i ursprunget till enantiomerisk anrikning som finns överallt i livet idag.
Variationer
Silikaympade katalysatorer
Silikaympad polyleucin har visat sig effektivt katalysera epoxidation av a,β-omättade aromatiska ketoner. Kiseldioxidympningen gör att katalysatorn lätt kan återvinnas med endast mild förlust av aktivitet och är särskilt användbar för uppskalningsreaktioner.
Bifasiska (icke-vattenhaltiga) reaktionsbetingelser
För det alternativa tvåfasiga protokollet löses olefinsubstratet i tetrahydrofuran (THF) tillsammans med ureaväteperoxid (UHP) -oxidanten och en tertiär aminbas såsom 8-diazabicyklo[5.4.0]undec-7-en (DBU. ) Den immobiliserade polymerkatalysatorn bildar en pasta som tjänar som reaktionsställe. Tvåfasreaktionsbetingelserna utökade intervallet av enoner på vilka reaktionen kunde appliceras.
Monofasiska reaktionsbetingelser med PEG-immobiliserat polyleucin
En löslig initiator O,O'-bis(2-aminoetyl)polyetylenglykol (diaminoPEG) för polyleucinsammansättning användes för att generera en THF-löslig triblockpolymer . Användning av denna katalysator under homogena reaktionsbetingelser möjliggjorde en markant utvidgning av metodiken till a,β-omättade ketoner , diener och bis -diener.
Fasöverföring samkatalys
Tillsats av tetrabutylammoniumbromid som en fasöverföringskatalysator ökar dramatiskt reaktionshastigheten. Samkatalysatorn antas öka koncentrationen av peroxidoxidanten i den organiska fasen, vilket möjliggör mer effektiv tillgång till det reaktiva ternära komplexet. Dessa villkor har utvecklats för tillämpning på tvåfassystem men fungerar även för trefassystem och har använts upp till 100g-skalan
Skala upp
Immobiliserade katalysatorer har använts i membranreaktorer och undersöks för tillämpning på reaktorer med kontinuerligt flöde med fast bädd.
Tillämpningar på syntes
Total syntes av Diltiazem
Adger et al. använde den bifasiska Juliá–Colonna-epoxideringen med immobiliserad poly-L-leucin (I-PLL) och ureaväteperoxid (UHP), och 8-diazabicyklo[5.4.0]undec-7-en (DBU) som nyckelsteget i effektiv syntes av Diltiazem (Figur 6.) Diltiazem är ett kommersiellt tillgängligt läkemedel som fungerar som en kalciumkanalblockerare .
Total syntes av (+)-clausenamid
Cappi et al. använde Juliá–Colonna-epoxidationen med PEG-immobiliserad poly-L-leucin (PEG-PLL) och DABCO väteperoxid (DABCO-H 2 O 2 ) eller urea väteperoxid (UHP) i ett miniatyrsystem med fast bädd kontinuerligt flöde ( Figur 7.) Detta protokoll utnyttjades för att syntetisera (+)-clausenamid som ett bevis på konceptet i utvecklingen av det nya reaktionsprotokollet; (+)-clausenamid uppvisar anti-amnesiac och hepatoskyddande aktivitet.
Total syntes av (+)-goniotriol 7, (+)-goniofufuron 8, (+)-8-acetylgoniotriol 9 och gonio-pyron
Chen et al. använde det bifasiska Juliá–Colonna-epoxidationsprotokollet med ureaväteperoxid (UHP), poly-L-leucin (PLL) och 8-diazabicyklo[5.4.0]undec-7-en (DBU) som ett nyckelsteg i syntesen av en familj av styryllaktoner isolerade från Goniothalamus giganteus (Figur 8.) Dessa föreningar, inklusive (+)-goniotriol 7, (+)-goniofufuron 8, (+)-8-acetylgoniotriol 9 och gonio-pyron, har visat cytotoxisk aktivitet mot mänskliga tumörceller.
Se även
- Prilezhaev reaktion
- Jørgensen epoxidation
- Asymmetrisk nukleofil epoxidation