In vitro spermatogenes
In vitro spermatogenes är processen att skapa manliga gameter ( spermatozoer ) utanför kroppen i ett odlingssystem. Processen kan vara användbar för fertilitetsbevarande, infertilitetsbehandling och kan ytterligare utveckla förståelsen av spermatogenes på cellulär och molekylär nivå.
Spermatogenes är en mycket komplex process och att artificiellt återuppbygga den in vitro är utmanande. Dessa inkluderar att skapa en liknande mikromiljö som den i testiklarna samt att stödja endokrina och parakrina signaler, och säkerställa överlevnad av de somatiska cellerna och könscellerna från spermatogoniella stamceller (SSC) till mogna spermier.
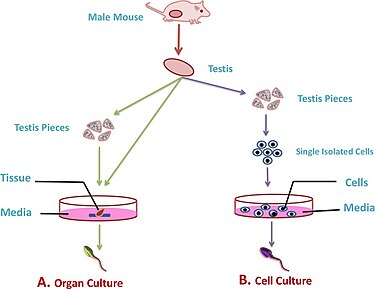
Olika metoder för odling kan användas i processen såsom isolerade cellkulturer , fragmentkulturer och 3D-kulturer
Kulturtekniker
Isolerade cellkulturer
Cellkulturer kan inkludera antingen monokulturer, där en cellpopulation odlas, eller samodlingssystem, där flera cellinjer (måste vara minst två) kan odlas tillsammans. Celler isoleras initialt för odling genom att enzymatiskt smälta testikelvävnaden för att separera de olika celltyperna för odling. Processen att isolera celler kan leda till cellskador.
Den största fördelen med monokultur är att effekten av olika påverkan på en specifik cellpopulation av celler kan undersökas. [ citat behövs ] Samkultur möjliggör att interaktioner mellan cellpopulationer kan observeras och experimenteras på, vilket ses som en fördel jämfört med monokulturmodellen.
Isolerad cellodling, specifikt samodling av testikelvävnad, har varit en användbar teknik för att undersöka inverkan av specifika faktorer såsom hormoner eller olika matarceller på progressionen av spermatogenes in vitro . [ citat behövs ] Till exempel har faktorer som temperatur, matarcellspåverkan och rollen av testosteron och follikelstimulerande hormon (FSH) alla undersökts med hjälp av isolerade cellodlingstekniker.
Studier har kommit fram till att olika faktorer kan påverka odlingen av könsceller, t.ex. media, tillväxtfaktorer, hormoner och temperatur. Till exempel, när man odlar odödliga könsceller från mus vid temperaturer på 35, 37 och 29 ℃, förökar dessa celler snabbast vid den högsta temperaturen och minst snabbt vid den lägsta, men det fanns olika nivåer av differentiering. Vid den högsta temperaturen upptäcktes ingen differentiering, en del sågs vid 37 ℃ och några tidiga spermatider uppträdde vid 32 ℃. Isolerad cellodlingsteknik har framgångsrikt använts för in vitro-produktion av spermier med hjälp av mus som djurmodell.
Undersökningar av lämpliga matarceller drog slutsatsen att en mängd olika celler kunde uppmuntra utvecklingen av könsceller såsom Sertoli-celler , Leydig-celler och peritubulära myoidceller, men den mest väsentliga är Sertoli-celler, men Leydig- och peritubulära myoidceller bidrar båda till mikromiljön som uppmuntrar stamceller celler att förbli pluripotenta och självförnya sig i testiklarna.
Testes fragment kulturer
I fragmentkulturer avlägsnas testiklarna och vävnadsfragment odlas i kompletterande media som innehåller olika tillväxtfaktorer för att inducera spermatogenes och bilda funktionella gameter. Utvecklingen av denna odlingsteknik har huvudsakligen skett med användning av djurmodeller t.ex. möss eller råtttestisvävnad.
Fördelen med att använda denna metod är att den bibehåller det naturliga rumsliga arrangemanget av seminiferous tubuli . Hypoxi är dock ett återkommande problem i dessa kulturer där den låga syretillförseln hindrar utvecklingen och mognaden av spermatider (betydligt mer i vuxna än omogna testikelvävnader). Andra utmaningar med denna typ av odling inkluderar att bibehålla strukturen på seminiferous tubuli vilket gör det svårare för långvariga cellkulturer eftersom vävnadsstrukturerna kan plana ut vilket gör det svårt att arbeta med. För att lösa några av dessa problem kan 3D-kulturer användas.
År 2012 isolerades mogna spermier som kan befruktas från in vitro -odling av omogen mustestikelvävnad.
3D-kulturer
3D-kulturer använder svamp, modeller eller byggnadsställningar som liknar elementen i den extracellulära matrisen för att uppnå en mer naturlig rumslig struktur av seminiferous tubuli och för att bättre representera vävnaderna och interaktionen mellan olika celltyper i ett ex vivo- experiment. Olika komponenter i den extracellulära matrisen såsom kollagen, agar och kalciumalginat används vanligtvis för att bilda gelen eller ställningen som kan ge syre och näringsämnen. För att föröka 3D-kulturer, bäddas testikelcellkulturer in i den porösa svampen/ställningen och tillåts kolonisera strukturen som sedan kan överleva i flera veckor för att tillåta spermatogoni att differentiera och mogna till spermier.
Dessutom möjliggör skakning av 3D-kulturer under såningsprocessen en ökad syretillförsel som hjälper till att övervinna problemet med hypoxi och på så sätt förbättrar cellernas livslängd.
I motsats till monokulturer kan fragment/3D-kulturer etablera in vitro- förhållanden som något kan likna testikelmikromiljön för att möjliggöra en mer exakt studie av testikelfysiologin och dess associationer med in vitro- utvecklingen av spermaceller.
Framtida implikationer
Vetenskaplig
Förmågan att rekapitulera spermatogenes In vitro ger en unik möjlighet att studera denna biologiska process genom ofta billigare och snabbare forskningsmetod än in vivo- arbete. Observation är ofta lättare in vitro , eftersom målcellerna för det mesta är isolerade och orörliga. En annan betydande fördel med in vitro -forskning är den lätthet med vilken miljöfaktorer kan ändras och övervakas. Det finns också tekniker som inte är praktiska eller genomförbara in vivo som nu kan utforskas.
In vitro -arbete är inte utan sina egna utmaningar. Till exempel förlorar man den naturliga strukturen som tillhandahålls av in vivo , och därmed cellförbindelser som kan vara viktiga för vävnadens funktion.
Klinisk
Även om gnagares spermatogenes inte är identisk med sin mänskliga motsvarighet, särskilt på grund av den höga utvecklingshastigheten för det manliga fortplantningsorganet, är dessa tekniker en solid utgångspunkt för framtida mänskliga tillämpningar.
Olika kategorier av infertila män kan dra nytta av framsteg inom dessa tekniker, särskilt de som saknar livskraftig könscellsproduktion. Dessa män kan till exempel inte dra nytta av tekniker för spermieextraktion och har för närvarande små eller inga alternativ för att producera genetiska ättlingar.
Män som har genomgått kemo-/strålbehandling före puberteten kan dra nytta av spermatogenes in vitro . Dessa människor hade inte möjligheten att kryobevara livskraftiga spermier innan deras ingrepp, och därför är förmågan att generera genetiskt härstammande spermier senare i livet ovärderlig. Möjliga metoder som skulle kunna tillämpas (på denna och andra grupper) är induktion av spermatogenes i testikelprover tagna före puberteten, eller, om dessa prover inte är tillgängliga/livskraftiga, kan nya metoder som manipulerar stamcellsdifferentiering producera SSC:er "från grunden", med hjälp av vuxna stamcellsprover .
En alternativ metod är att transplantera bevarad vävnad tillbaka på vuxna canceröverlevande, men detta medför operativa risker, såväl som en risk för återinförande av maligna celler. Även om man använder denna metod in vitro -spermatogenes möjliggöra provexpansion och observation för att bättre säkerställa kvalitet och kvantitet av transplantatvävnad.
Hos de med friska eller bevarade SSC:er men utan en cellulär miljö för att stödja dem, kan in vitro spermatogenes användas efter transplantation av SSC:erna i frisk donatorvävnad.
En annan grupp som skulle kunna bli hjälpt av in vitro spermatogenes är de med någon form av genetiska hinder för spermieproduktion. De utan livskraftig SSC-utveckling är ett uppenbart mål, men också de med varierande nivåer av spermatogen arrestering; tidigare har deras underutvecklade könsceller injicerats i oocyter, men detta har en framgångsfrekvens på endast 3 % hos människor.
Slutligen kan in vitro spermatogenes med användning av animaliska eller mänskliga celler användas för att bedöma effekterna och toxiciteten av läkemedel före in vivo- testning.