Hauser bas
Hauserbaser , även kallade magnesiumamidbaser , är magnesiumföreningar som används inom organisk kemi som baser för metalliseringsreaktioner . Dessa föreningar beskrevs först av Charles R. Hauser 1947. Jämfört med organolitiumreagenser har magnesiumföreningarna mer kovalenta, och därför mindre reaktiva, metall-ligandbindningar. Följaktligen uppvisar de en högre grad av funktionell grupptolerans och en mycket större kemoselektivitet . I allmänhet används Hauser-baser vid rumstemperatur medan reaktioner med organolitiumreagenser utförs vid låga temperaturer, vanligtvis vid -78 °C.
Strukturera
Solid state struktur
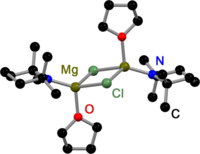
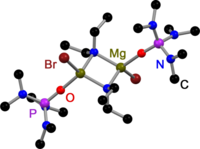
Liksom alla Grignard- dimerer är Hauser-baser härledda från 2,2,6,6-tetrametylpiperidin (TMP) och HMDS överbryggade av halogenider i fast tillstånd. I motsats till Grignard-reagenser, existerar även dimera amidobryggade Hauser-baser. Alla har en gemensam: de överbryggas av mindre skrymmande amidoligander som Et 2 N−, Ph 3 P=N− och i Pr 2 N−. Förskjutningen till halogenidbryggor kan vara ett resultat av de skrymmande grupperna på amidliganden.
| . | . | . |
Lösningsstruktur
Även om det finns en hel del information om användbarheten av dessa reagens, är mycket lite känt om naturen hos Hauser-baser i lösning. En anledning till den bristen på information är att Hauser-baser visar ett komplext beteende i lösning. Det föreslogs att det skulle kunna likna Schlenk-jämvikten för Grignard-reagenser i eterlösning, där mer än en magnesiumhaltig art existerar. År 2016, Neufeld et al. visade med diffusionsordnad spektroskopi (DOSY) att lösningsstrukturen för i Pr 2 NMgCl representeras bäst av den gemensamma Schlenk-jämvikten:
- i Pr 2 NMgCl ( A ) ⇌ ( i Pr 2 N) 2 Mg ( B ) + MgCl 2
Denna jämvikt är starkt temperaturberoende med heteroleptisk ( A ) som huvudart vid höga temperaturer och homoleptisk ( B ) vid låga temperaturer. Dimeriska ämnen med överbryggande klorider och amider är också närvarande i THF-lösningen, även om alkylmagnesiumklorider inte dimeriserar i THF. Vid låga temperaturer, där ett överskott av MgCl2 är tillgängligt, är MgCl2- samkoordinerade arter också närvarande i lösning.
Förberedelse
Hauserbaserna framställs genom att blanda en amin och ett Grignard-reagens .
- R2NH + R'MgX → R2NMgX + R'H X = Cl , Br, I
Används
Hauserbaser används vanligtvis som metalliseringsreagens , som organolitium eller metallamider . Genombrottet i syntetiska protokoll för Hauserbaser kulminerar på 1980- och 1990-talen. Eaton och medarbetare visade att iPr2NMgBr selektivt magnesierar karboxamider i ortoposition. Senare rapporterade Kondo, Sakamo och medarbetare användbarheten av iPr 2 NMgX (X = Cl, Br) som selektiva deprotoneringsreagens ( endast i 2-positionen) för heterocyklisk tiofen och fenylsulfonylsubstituerade indoler.
En stor nackdel med Hauser-baser är deras dåliga löslighet i THF. Som en konsekvens är metalliseringshastigheterna långsamma och ett stort överskott av bas krävs (oftast 10 ekv.). Denna omständighet komplicerar funktionaliseringen av den metalliserade mellanprodukten med en elektrofil. Bättre löslighet och reaktivitet kan uppnås genom att tillsätta stökiometriska mängder LiCl till Hauser-basen. Dessa så kallade Turbo -Hauser-baser som t.ex. TMPMgCl·LiCl och i Pr 2 NMgCl·LiCl är kommersiellt tillgängliga och visar en förbättrad kinetisk basicitet, utmärkt regioselektivitet och hög funktionell grupptolerans för ett stort antal aromatiska och heteroaromatiska substrat.
Vanligt använda Hauser-baser
- i Pr 2 NMgX
- TMPMgX ( TMP = 2,2,6,6,tetrametylpiperidino, X= Cl, Br)