Gibbs isoterm
Gibbs adsorptionsisoterm för flerkomponentsystem är en ekvation som används för att relatera förändringar i koncentrationen av en komponent i kontakt med en yta med förändringar i ytspänningen, vilket resulterar i en motsvarande förändring i ytenergi . För ett binärt system är Gibbs adsorptionsekvation i termer av ytöverskott:
var
- är ytspänningen ,
- i är ytöverskottskoncentrationen av komponent i,
- i är den kemiska potentialen för komponent i.
Adsorption
Olika påverkan vid gränssnittet kan orsaka förändringar i sammansättningen av det ytnära lagret. Ämnen kan antingen ackumuleras nära ytan eller, omvänt, flytta in i bulken. Molekylernas rörelser kännetecknar adsorptionsfenomenen . Adsorption påverkar förändringar i ytspänning och kolloidstabilitet . Adsorptionsskikt på ytan av ett flytande dispersionsmedium kan påverka interaktionerna mellan de dispergerade partiklarna i mediet och följaktligen kan dessa skikt spela en avgörande roll för kolloidstabiliteten. Adsorptionen av molekyler i vätskefas vid en gränsyta sker när denna vätskefas är i kontakt med andra oblandbara faser som kan vara gas, flytande eller fast
Konceptuell förklaring av ekvationen
Ytspänning beskriver hur svårt det är att förlänga en yta (genom att sträcka ut eller förvränga den). Om ytspänningen är hög krävs en stor fri energi för att öka ytan, så ytan tenderar att dra ihop sig och hålla ihop som en gummiduk.
Det finns olika faktorer som påverkar ytspänningen, varav en är att ytans sammansättning kan skilja sig från bulken. Till exempel, om vatten blandas med en liten mängd ytaktiva ämnen (till exempel handtvål ), kan bulkvattnet vara 99 % vattenmolekyler och 1 % tvålmolekyler, men den översta ytan av vattnet kan vara 50 % vattenmolekyler och 50% tvålmolekyler. I det här fallet har tvålen ett stort och positivt "ytöverskott". I andra exempel kan ytöverskottet vara negativt: Till exempel, om vatten blandas med ett oorganiskt salt som natriumklorid , är vattnets yta i genomsnitt mindre salt och renare än bulkgenomsnittet.
Tänk återigen exemplet med vatten med lite tvål. Eftersom vattenytan måste ha högre koncentration av tvål än bulken, är det nödvändigt att ta bort tvålmolekyler från bulken närhelst vattnets yta ökas och lägga till dem på den nya ytan. Om koncentrationen av tvål ökas en aning, är tvålmolekylerna mer lättillgängliga (de har högre kemisk potential ), så det är lättare att dra dem från bulken för att skapa den nya ytan. Eftersom det är lättare att skapa ny yta sänks ytspänningen. Den allmänna principen är:
- När ytöverskottet för en komponent är positivt, minskar en ökning av den kemiska potentialen för den komponenten ytspänningen.
Överväg sedan exemplet med vatten med salt. Vattenytan är mindre salt än bulk, så närhelst vattnets yta ökas är det nödvändigt att ta bort saltmolekyler från den nya ytan och pressa dem till bulk. Om koncentrationen av salt ökas en aning (höjer saltets kemiska potential ) blir det svårare att trycka bort saltmolekylerna. Eftersom det nu är svårare att skapa den nya ytan är ytspänningen högre. Den allmänna principen är:
- När ytöverskottet för en komponent är negativt ökar ytspänningen genom att öka den kemiska potentialen för den komponenten.
Gibbs isotermekvation ger det exakta kvantitativa sambandet för dessa trender.
Placering av yta och definierande ytöverskott
Ytans placering
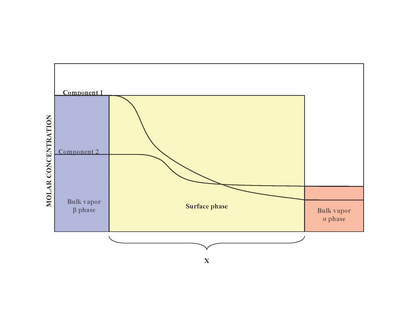
I närvaro av två faser ( a och β ) är ytan (ytfasen) belägen mellan fasen a och fasen β . Experimentellt är det svårt att bestämma den exakta strukturen av en inhomogen ytfas som är i kontakt med en bulkvätskefas som innehåller mer än ett löst ämne. Inhomogenitet hos ytfasen är ett resultat av variation av molförhållanden. En modell som föreslagits av Josiah Willard Gibbs föreslog att ytfasen skulle vara en idealiserad modell som hade noll tjocklek. I verkligheten, även om bulkregionerna av α- och β -faserna är konstanta, kommer koncentrationerna av komponenter i gränssnittsregionen gradvis att variera från bulkkoncentrationen av α till bulkkoncentrationen av β över avståndet x. Detta i motsats till den idealiserade Gibbs-modellen där avståndet x får värdet noll. Diagrammet till höger illustrerar skillnaderna mellan de verkliga och idealiserade modellerna.
Definition av ytöverskott
I den idealiserade modellen förblir de kemiska komponenterna i α- och β -bulkfaserna oförändrade förutom när de närmar sig delningsytan. Det totala antalet mol av någon komponent (exempel inkluderar: vatten, etylenglykol etc.) förblir konstant i bulkfaserna men varierar i ytfasen för den verkliga systemmodellen som visas nedan.
I det verkliga systemet varierar dock den totala mängden mol av en komponent beroende på den godtyckliga placeringen av delningsytan. Det kvantitativa måttet på adsorption av den i -te komponenten fångas av ytöverskottskvantiteten. Ytöverskottet representerar skillnaden mellan det totala antalet mol av den i -te komponenten i ett system och molerna av den i -te komponenten i en viss fas (antingen α eller β ) och representeras av:
där Γ i är ytöverskottet för den i -te komponenten, n är molerna, α och β är faserna och A är arean av den delande ytan.
Γ representerar överskott av löst ämne per ytenhet över vad som skulle finnas om bulkkoncentrationen rådde hela vägen till ytan, den kan vara positiv, negativ eller noll. Den har enheter av mol/m 2 .
Relativt ytöverskott
Relativa ytöverskottskvantiteter är mer användbara än godtyckliga ytöverskottskvantiteter. Det relativa ytöverskottet relaterar adsorptionen vid gränsytan till ett lösningsmedel i bulkfasen. En fördel med att använda de relativa ytöverskottsmängderna är att de inte beror på platsen för delningsytan. Det relativa ytöverskottet av art i och lösningsmedel 1 är därför:
Gibbs adsorptionsisotermekvation
Härledning av Gibbs adsorptionsekvation
För ett tvåfassystem som består av α- och β -fasen i jämvikt med en yta S som delar faserna, kan den totala Gibbs fria energin för ett system skrivas som:
där G är Gibbs fria energi.
Ekvationen för Gibbs adsorptionsisoterm kan härledas från "särskildheten till termodynamiken i Eulersatsen på homogena första ordningens former." Gibbs fria energi för varje fas α , fas β , och ytfasen kan representeras av ekvationen:
där U är den inre energin, p är trycket, V μi är volymen, T är temperaturen, S är entropin och är den i -te komponentens kemiska potential.
Genom att ta den totala derivatan av Euler-formen av Gibbs ekvation för α -fasen, β -fasen och ytfasen:
där A är arean av delningsytan och γ är ytspänningen .
För reversibla processer kräver termodynamikens första lag att:
där q är värmeenergin och w är arbetet.
Att ersätta ovanstående ekvation med den totala derivatan av Gibbs energiekvation och genom att använda resultatet γd A likställs med icke-tryckvolymarbetet när ytenergi beaktas:
genom att använda den fundamentala ekvationen för Gibbs energi i ett flerkomponentsystem:
Ekvationen som relaterar α -fasen, β -fasen och ytfasen blir:
När man betraktar bulkfaserna ( α- fas, β -fas), vid jämvikt vid konstant temperatur och tryck kräver Gibbs–Duhem-ekvationen att:
Den resulterande ekvationen är Gibbs adsorptionsisotermekvation:
Gibbs adsorptionsisoterm är en ekvation som kan betraktas som en adsorptionsisoterm som kopplar samman ytspänningen hos en lösning med koncentrationen av det lösta ämnet.
För ett binärt system som innehåller två komponenter är Gibbs adsorptionsekvation i termer av ytöverskott:
Samband mellan ytspänning och ytöverskottskoncentrationen
Den kemiska potentialen för art i i lösning beror på aktiviteten a med följande ekvation:
där μ i är den kemiska potentialen för den i -te komponenten, μ i o är den kemiska potentialen för den i -te komponenten vid ett referenstillstånd, R är gaskonstanten , T är temperaturen och a i är aktiviteten för den i -te komponenten.
Differentiering av den kemiska potentialekvationen resulterar i:
där f är aktivitetskoefficienten för komponent i , och C är koncentrationen av species i i bulkfasen.
Om lösningarna i α- och β -faserna är utspädda (rika på en viss komponent i ) närmar sig aktivitetskoefficienten för komponent i enhet och Gibbs-isotermen blir:
Ovanstående ekvation antar att gränssnittet är tvådimensionellt, vilket inte alltid är sant. Ytterligare modeller, som Guggenheims, rättar till denna brist.
Joniska dissociationseffekter
Gibbs ekvation för elektrolytadsorption
Betrakta ett system som består av vatten som innehåller en organisk elektrolyt RNaz och en oorganisk elektrolyt NaCl som båda dissocierar fullständigt så att:
Gibbs adsorptionsekvation i termer av det relativa ytöverskottet blir:
Förhållandet mellan ytspänning och ytöverskottskoncentrationen blir:
där m är koefficienten för Gibbs adsorption. Värden på m beräknas med hjälp av dubbelskiktsmodellerna (gränssnitt) av Helmholtz , Gouy och Stern .
Ämnen kan ha olika effekter på ytspänningen som visas: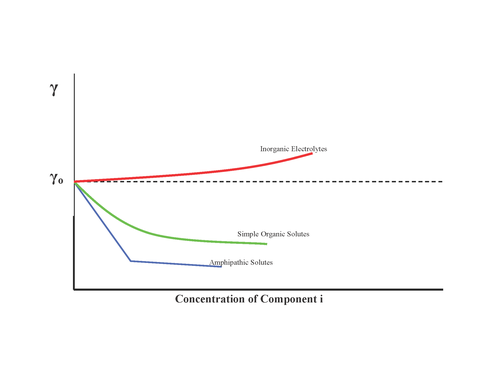
- Ingen effekt, till exempel socker
- Ökning av ytspänning, oorganiska salter
- Minska ytspänningen gradvis, alkoholer
- Minska ytspänningen och, när ett minimum har uppnåtts, ingen mer effekt: ytaktiva ämnen
Därför förutspår Gibbs isoterm att oorganiska salter har negativa ytkoncentrationer. Denna uppfattning har dock ifrågasatts i stor utsträckning under de senaste åren på grund av en kombination av mer exakta gränssnittskänsliga experiment och teoretiska modeller, som båda förutsäger en ökning i ytbenägenhet för halogeniderna med ökande storlek och polariserbarhet. Som sådan är ytspänning inte en tillförlitlig metod för att bestämma jonernas relativa benägenhet mot luft-vattengränsytan.
En metod för att bestämma ytkoncentrationer behövs för att bevisa modellens giltighet: två olika tekniker används normalt: ellipsometri och efter sönderfallet av 14 C som finns i de ytaktiva molekylerna.
Gibbs isoterm för joniska ytaktiva ämnen
Joniska ytaktiva ämnen kräver speciella överväganden, eftersom de är elektrolyter :
- I frånvaro av extra elektrolyter
där avser ytkoncentrationen av ytaktiva molekyler, utan hänsyn till motjonen.
- I närvaro av tillsatta elektrolyter
Experimentella metoder
Omfattningen av adsorption vid ett vätskegränssnitt kan utvärderas med hjälp av ytspänningskoncentrationsdata och Gibbs adsorptionsekvation. Mikrotombladsmetoden används för att bestämma vikten och molkoncentrationen av ett gränssnitt . Metoden innebär att man uppnår en en kvadratmeter del av luft-vätskegränssnittet av binära lösningar med användning av ett mikrotomblad .
En annan metod som används för att bestämma omfattningen av adsorption vid ett luft-vatten-gränssnitt är emulsionstekniken, som kan användas för att uppskatta det relativa ytöverskottet med avseende på vatten.
Dessutom kan Gibbs ytöverskott av en ytaktiv komponent för en vattenlösning hittas med användning av den radioaktiva spårningsmetoden . Den ytaktiva komponenten är vanligtvis märkt med kol-14 eller svavel-35.
- ^ a b c d Shchukin, ED, Pertsov, AV, Amelina EA och Zelenev, AS Kolloid- och ytkemi. 1:a uppl. Mobius D. och Miller R. Vol. 12. Amsterdam: Elsevier Science BV 2001.
- ^ a b c Hiemenz, Paul C. och Rajagopalan, Raj. Principer för kolloid- och ytkemi. 3:e uppl. New York: Marcel Dekker, Inc., 1997.
- ^ a b c d e f g Chattoraj, DK och Birdi, KS Adsorption and the Gibbs Surface Excess. New York: Plenum Publishing Company, 1984.
- ^ Callen, Herbert B. Termodynamik och en introduktion till termostatik . 2:a uppl. Kanada: John Wiley & Sons, Inc., 1985.
- ^ Petersen, Poul B.; Saykally, Richard J. (2006). "Om jonernas natur vid den flytande vattenytan". Årlig översyn av fysikalisk kemi . 57 (1): 333–364. doi : 10.1146/annurev.physchem.57.032905.104609 .