Fluorescensåtervinning efter fotoblekning
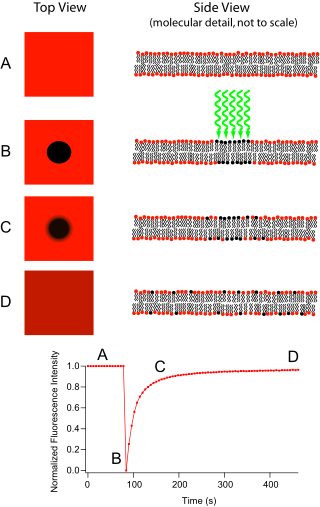
Fluorescensåtervinning efter fotoblekning (FRAP) är en metod för att bestämma kinetiken för diffusion genom vävnad eller celler. Det är kapabelt att kvantifiera den tvådimensionella laterala diffusionen av en molekylärt tunn film som innehåller fluorescensmärkta prober, eller att undersöka enstaka celler. Denna teknik är mycket användbar i biologiska studier av cellmembrandiffusion och proteinbindning. Dessutom möjliggör ytavsättning av ett fluorescerande fosfolipiddubbelskikt (eller monoskikt) karakterisering av hydrofila (eller hydrofoba ) ytor i termer av ytstruktur och fri energi.
Liknande, men mindre välkända, tekniker har utvecklats för att undersöka den 3-dimensionella diffusionen och bindningen av molekyler inuti cellen; de kallas också FRAP.
Experimentuppställning
Den grundläggande apparaten består av ett optiskt mikroskop , en ljuskälla och någon fluorescerande sond. Fluorescerande emission är beroende av absorption av en specifik optisk våglängd eller färg som begränsar valet av lampor. Vanligast är att en kvicksilver- eller xenonkälla med brett spektrum används tillsammans med ett färgfilter. Tekniken börjar med att spara en bakgrundsbild av provet innan fotoblekning. Därefter fokuseras ljuskällan på en liten fläck av det synliga området antingen genom att byta till ett mikroskopobjektiv med högre förstoring eller med laserljus av lämplig våglängd. Fluoroforerna i denna region får högintensiv belysning som gör att deras fluorescenslivslängd snabbt förflyter (begränsad till ungefär 10 5 fotoner före utsläckning). Nu är bilden i mikroskopet av ett likformigt fluorescerande fält med en märkbar mörk fläck. När Brownsk rörelse fortskrider kommer de fortfarande fluorescerande sonderna att diffundera genom provet och ersätta de icke-fluorescerande sonderna i den blekta regionen. Denna diffusion fortskrider på ett ordnat sätt, analytiskt bestämmande från diffusionsekvationen . Om man antar en gaussisk profil för blekningsstrålen, kan diffusionskonstanten D enkelt beräknas från:
där w är strålens radie och t D är den "karakteristiska" diffusionstiden.
Ansökningar
Understödda lipiddubbelskikt
Ursprungligen var FRAP-tekniken avsedd att användas som ett sätt att karakterisera rörligheten hos enskilda lipidmolekyler i ett cellmembran. Samtidigt som den ger stor användbarhet i denna roll, lutar nuvarande forskning mer mot undersökning av artificiella lipidmembran. Understödda av hydrofila eller hydrofoba substrat (för att producera lipiddubbelskikt respektive monolager) och inkorporerande membranproteiner , är dessa biomimetiska strukturer potentiellt användbara som analytiska enheter för att bestämma identiteten av okända substanser, förstå cellulär transduktion och identifiera ligandbindningsställen.
Proteinbindning
Denna teknik används ofta tillsammans med grönt fluorescerande protein (GFP) fusionsproteiner , där det studerade proteinet fusioneras till en GFP. När det exciteras av en specifik ljusvåglängd kommer proteinet att fluorescera. När proteinet som studeras produceras med GFP, kan fluorescensen spåras. Att fotoförstöra GFP och sedan titta på återpopulationen till det blekta området kan avslöja information om proteininteraktionspartners, organellkontinuitet och proteinhandel.
Om fluorescensen efter en tid inte når den initiala nivån längre, orsakas en del av fluorescensen av en orörlig fraktion (som inte kan fyllas på genom diffusion). På liknande sätt, om de fluorescerande proteinerna binder till statiska cellreceptorer, kommer återhämtningshastigheten att fördröjas av en faktor som är relaterad till associations- och disassociationskoefficienterna för bindning. Denna observation har senast utnyttjats för att undersöka proteinbindning. På liknande sätt, om det GFP-märkta proteinet är konstitutivt införlivat i ett större komplex, kommer dynamiken för fluorescensåtervinning att kännetecknas av diffusionen av det större komplexet.
Applikationer utanför membranet
FRAP kan också användas för att övervaka proteiner utanför membranet. Efter att proteinet av intresse har gjorts fluorescerande, vanligtvis genom uttryck som ett GFP-fusionsprotein, används ett konfokalmikroskop för att fotobleka och övervaka en region av cytoplasman , mitotiska spindeln , kärnan eller en annan cellulär struktur. Den genomsnittliga fluorescensen i regionen kan sedan plottas mot tiden sedan fotoblekningen, och den resulterande kurvan kan ge kinetiska koefficienter, såsom de för proteinets bindningsreaktioner och/eller proteinets diffusionskoefficient i mediet där det övervakas. Ofta är den enda dynamiken som beaktas diffusion och bindande/avbindande interaktioner, men i princip kan proteiner också röra sig via flöde, dvs genomgå riktad rörelse, och detta upptäcktes mycket tidigt av Axelrod et al. Detta kan bero på flöde av cytoplasman eller nukleoplasman, eller transport längs filament i cellen såsom mikrotubuli med molekylära motorer .
Analysen är enklast när fluorescensåtervinningen begränsas av antingen diffusionshastigheten in i det blekta området eller av hastigheten med vilken blekta proteiner binds bort från sina bindningsställen inom det blekta området och ersätts av fluorescerande protein. Låt oss titta på dessa två gränser, för det vanliga fallet med blekning av ett GFP-fusionsprotein i en levande cell.
Diffusionsbegränsad fluorescensåtervinning
För en cirkulär blekningsfläck med radie och diffusionsdominerad återhämtning, beskrivs fluorescensen av en ekvation härledd av Soumpasis (som involverar modifierade Bessel-funktioner och )
med den karakteristiska tidsskalan för diffusion, och är tiden. är den normaliserade fluorescensen (går till 1 när går till oändlighet). Diffusionstidsskalan för en blekt fläck med radie är , med D diffusionskoefficient.
Observera att detta är för ett ögonblickligt blekmedel med en stegfunktionsprofil, dvs. andelen av protein som antas blekas omedelbart vid tidpunkten är och , för avståndet från mitten av det blekta området. Det antas också att återvinningen kan modelleras genom diffusion i två dimensioner, det vill säga både enhetlig och isotropisk. Med andra ord, den diffusionen sker i ett likformigt medium så den effektiva diffusionskonstanten D är densamma överallt, och att diffusionen är isotrop, dvs sker i samma takt längs alla axlar i planet.
I praktiken kommer inga av dessa antaganden att vara strikt sanna i en cell.
- Blekning kommer inte att ske omedelbart. Särskilt om kraftig blekning av ett stort område krävs, kan blekning ta en betydande del av diffusionstidsskalan . Då kommer en betydande del av det blekta proteinet att diffundera ut ur det blekta området under blekning. Att inte ta hänsyn till detta kommer att införa ett betydande fel i D .
- Den blekta profilen kommer inte att vara en radiell stegfunktion. Om den blekta fläcken i själva verket är en enda pixel kommer blekningen som funktion av positionen typiskt att vara diffraktionsbegränsad och bestämmas av optiken hos det använda konfokala laserskanningsmikroskopet . Detta är inte en radiell stegfunktion och varierar också längs axeln vinkelrätt mot planet.
- Celler är naturligtvis tredimensionella inte tvådimensionella, liksom den blekta volymen. Att försumma diffusion ut ur planet (vi antar att detta är xy- planet) kommer att vara en rimlig approximation endast om fluorescensen återhämtar sig huvudsakligen via diffusion i detta plan. Detta gäller till exempel om en cylindrisk volym blekes med cylinderaxeln längs z -axeln och med denna cylindriska volym genom hela cellens höjd. Då orsakar inte diffusion längs z -axeln fluorescensåtervinning eftersom allt protein blekas likformigt längs z -axeln, och därför är det ofarligt att försumma det, som Soumpasis ekvation gör. Men om diffusion längs z -axeln bidrar till fluorescensåtervinning måste det tas med i beräkningen.
- Det finns ingen anledning att förvänta sig att cellcytoplasman eller nukleoplasman är helt spatialt enhetlig eller isotrop.
Således är ekvationen för Soumpasis bara en användbar approximation, som kan användas när antagandena som anges ovan är bra approximationer till den verkliga situationen, och när återhämtningen av fluorescens verkligen begränsas av tidsskalan för diffusion τ D {\ . Observera att bara för att Soumpasis kan anpassas adekvat till data, betyder det inte nödvändigtvis att antagandena är sanna och att diffusion dominerar återhämtning.
Reaktionsbegränsad återhämtning
Ekvationen som beskriver fluorescensen som en funktion av tiden är särskilt enkel i en annan gräns. Om ett stort antal proteiner binder till platser i en liten volym så att där domineras fluorescenssignalen av signalen från bundna proteiner, och om denna bindning är i ett enda tillstånd med en off-rate koff, då fluorescensen som en funktion av tiden ges av
endast beror på hastighetskonstanten för avbindning, k off . Det beror inte på tillsatsen för bindning. Även om det beror på ett antal antaganden
- På-hastigheten måste vara tillräckligt stor för att den lokala koncentrationen av bundet protein ska avsevärt överstiga den lokala koncentrationen av fritt protein, och så att vi kan försumma bidraget till f av det fria proteinet.
- Reaktionen är en enkel bimolekylär reaktion, där proteinet binder till lokala platser som inte rör sig nämnvärt under återhämtningen
- Utbyte är mycket långsammare än diffusion (eller vilken transportmekanism som är ansvarig för rörlighet), eftersom den diffuserande fraktionen återhämtas snabbt och sedan fungerar som källan till fluorescerande protein som binder och ersätter det bundna blekta proteinet och därmed ökar fluorescensen. Med r radien för den blekta fläcken betyder detta att ekvationen endast är giltig om den bundna livslängden .
Om alla dessa antaganden är uppfyllda, kommer inpassning av en exponentiell till återhämtningskurvan att ge off rate-konstanten, k off . Men annan dynamik kan ge återhämtningskurvor som liknar exponentiala, så att passa en exponential innebär inte nödvändigtvis att återhämtningen domineras av en enkel bimolekylär reaktion. Ett sätt att skilja mellan återvinning med en hastighet som bestäms av obindning och återvinning som begränsas av diffusion, är att notera att återvinningsgraden för obindande begränsad återvinning är oberoende av storleken på det blekta området r , medan det skalar som , för diffusionsbegränsad återhämtning. Så om ett litet och ett stort område blekes, om återvinningen begränsas av obindning kommer återvinningshastigheterna att vara desamma för de två storlekarna av blekt område, medan om återhämtningen begränsas av diffusion kommer det att gå mycket långsammare för de större blekta områdena. område.
Diffusion och reaktion
I allmänhet kommer återhämtningen av fluorescens inte att domineras av vare sig enkel isotrop diffusion eller av en enda enkel avbindningshastighet. Det kommer att finnas både diffusion och bindning, och diffusionskonstanten kanske inte är enhetlig i rymden, och det kan finnas mer än en typ av bindningsställen, och dessa platser kan också ha en ojämn fördelning i rymden. Flödesprocesser kan också vara viktiga. Detta mer komplexa beteende innebär att en modell med flera parametrar krävs för att beskriva data; modeller med endast antingen en enda diffusionskonstant D eller en enda avstängningskonstant, k off , är otillräckliga.
Det finns modeller med både diffusion och reaktion. Tyvärr kan en enda FRAP-kurva ge otillräckliga bevis för att på ett tillförlitligt och unikt sätt passa (möjligen bullriga) experimentella data. Sadegh Zadeh et al. har visat att FRAP-kurvor kan anpassas av olika värdepar av diffusionskonstanten och on-rate-konstanten, eller, med andra ord, att passningar till FRAP är inte unika. Detta är i passningar med tre parametrar (on-rate konstant, off-rate konstant och diffusionskonstant). Passar som inte är unika, är i allmänhet inte användbara.
För modeller med ett antal parametrar kan således ett enda FRAP-experiment vara otillräckligt för att uppskatta alla modellparametrar. Då krävs mer data, t.ex. genom att bleka ytor av olika storlekar, bestämma vissa modellparametrar oberoende, etc.
















