Exergonisk reaktion
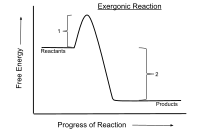
Inom kemisk termodynamik är en exergonisk reaktion en kemisk reaktion där förändringen i den fria energin är negativ (det finns en nettofrisättning av fri energi). Detta indikerar en spontan reaktion om systemet är stängt och initiala och slutliga temperaturer är desamma. För processer som sker i ett slutet system vid konstant tryck och temperatur används Gibbs fria energi , medan Helmholtz-energin är relevant för processer som sker vid konstant volym och temperatur. Varje reaktion som sker vid konstant temperatur utan inmatning av elektrisk eller fotonenergi är exergonisk, enligt termodynamikens andra lag . Ett exempel är cellandning .
Symboliskt betecknas frigörandet av fri energi, , i en exergonisk reaktion (vid konstant tryck och temperatur) som
Även om exergoniska reaktioner sägs inträffa spontant , betyder det inte att reaktionen kommer att ske i en observerbar hastighet . Till exempel disproportioneringen av väteperoxid fri energi men är mycket långsam i frånvaro av en lämplig katalysator. Det har föreslagits att ivriga skulle vara en mer intuitiv term i detta sammanhang.
Mer generellt hänför sig termerna exergonisk och endergonisk till den fria energiförändringen i alla processer, inte bara kemiska reaktioner. Däremot hänför sig termerna exotermisk och endotermisk till en entalpiförändring i ett slutet system under en process, vanligtvis förknippad med värmeutbytet .

